MirenaZusammensetzung und Freisetzungsform Intrauterinpessar. Beschreibung der Darreichungsform
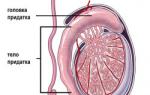
Das intrauterine Therapiesystem Mirena ist ein weißer oder fast weißer Hormon-Elastomer-Kern, der auf einem T-förmigen Körper sitzt und mit einer undurchsichtigen Membran bedeckt ist, die als eine Art Regulator für die Freisetzung des Wirkstoffs dient. Der T-förmige Körper hat an einem Ende eine Schlaufe mit einem daran befestigten Faden zum Entfernen der Spule und zwei Arme. Das Mirena-System befindet sich in einem Führungsrohr und ist frei von sichtbaren Verunreinigungen. Das Medikament wird in sterilen Blisterpackungen aus Polyester oder TYVEK-Material in einer Menge von 1 Stück geliefert.
Pharmakologische Wirkung
Das intrauterine System oder einfach das Mirena-IUP ist ein Arzneimittel, das darauf basiert lEvonorgestrel , das nach und nach in die Gebärmutterhöhle freigesetzt wird lokale gestagene Wirkung . Dank der aktiven Komponente des Therapeutikums wird die Empfindlichkeit der Östrogen- und Progesteronrezeptoren des Endometriums verringert, was sich in einer starken antiproliferativen Wirkung äußert.
Es gibt morphologische Veränderungen in der inneren Gebärmutterschleimhaut und schwach lokale Reaktion zu einem Fremdkörper in seiner Höhle. Schleimhaut Gebärmutterhalskanal wird deutlich verdichtet, was das Eindringen von Spermien in die Gebärmutter verhindert und die motorischen Fähigkeiten einzelner Spermien hemmt. In einigen Fällen wird auch eine Unterdrückung des Eisprungs festgestellt.
Durch den Einsatz von Mirena verändert sich der Charakter nach und nach Monatsblutung . In den ersten Monaten der Anwendung eines Intrauterinpessars kann es aufgrund der Hemmung der Endometriumproliferation zu einer Zunahme von Schmierblutungen und blutigem Ausfluss aus der Vagina kommen. Während sich die pharmakologische Wirkung des Therapeutikums entwickelt und die ausgeprägte Unterdrückung proliferativer Prozesse ihr Maximum erreicht, beginnt eine Phase spärlicher Blutungen, die oft in eine Phase geringer Blutung übergeht Oligo- Und Amenorrhoe .
3 Monate nach Beginn der Anwendung von Mirena wird der Menstruationsblutverlust bei Frauen um 62–94 % und nach 6 Monaten um 71–95 % reduziert. Diese pharmakologische Fähigkeit, die Art der Uterusblutung zu verändern, wird zur Behandlung genutzt idiopathische Menorrhagie in Abwesenheit hyperplastische Prozesse in den Membranen der weiblichen Geschlechtsorgane oder extragenitalen Erkrankungen, deren Pathogenese ein wesentlicher Bestandteil ist Hypokoagulation , da die Wirksamkeit des Arzneimittels vergleichbar ist mit chirurgische Methoden Behandlung.
Pharmakodynamik und Pharmakokinetik
Sobald das intrauterine System installiert ist, beginnt das Arzneimittel sofort zu wirken, was sich in einer allmählichen Freisetzung äußert Levonorgestrel und seine aktive Absorption, die anhand von Konzentrationsänderungen im Blutplasma beurteilt werden kann. Geschwindigkeit Die Freisetzung des Wirkstoffs beträgt zunächst 20 µg pro Tag und nimmt allmählich ab und erreicht nach 5 Jahren 10 µg pro Tag. Hormonspirale Mirena installiert hohe lokale Exposition , das für einen Konzentrationsgradienten des Wirkstoffs in Richtung vom Endometrium zum Myometrium sorgt (die Konzentration in den Wänden der Gebärmutter variiert um mehr als das Hundertfache).
Eintritt in den Körperkreislauf, Levonorgestrel Kontakte Molkenproteine Blut: 40-60 % der aktiven Komponente verbinden sich unspezifisch mit und 42-62 % der aktiven Komponente – insbesondere mit selektivem Sexualhormonträger SHBG . Etwa 1–2 % der Dosierung liegen im zirkulierenden Blut als freies Steroid vor. Während der Anwendung eines Therapeutikums nimmt die SHBG-Konzentration ab und der freie Anteil zu, was auf die Nichtlinearität der pharmakokinetischen Fähigkeit des Arzneimittels hinweist.
Nach dem Einsetzen der Mirena-Spirale in die Gebärmutterhöhle Levonorgestrel im Blutplasma wird nach 1 Stunde nachgewiesen und die maximale Konzentration wird nach 2 Wochen erreicht. Während klinische Studien Es ist erwiesen, dass die Konzentration des Wirkstoffs vom Körpergewicht der Frau abhängt – bei geringem Gewicht und/oder bei hohe Konzentration SHBG, die Menge der Hauptkomponente im Plasma ist höher.
Levonorgestrel unter Beteiligung verstoffwechselt Isoenzym CYP3A4 zu den endgültigen Stoffwechselprodukten in Form von konjugiertem und nicht-konjugiertem 3-Alpha und 5-Beta Tetrahydrolevonorgestrel Anschließend wird es über den Darm und die Nieren mit einem Ausscheidungskoeffizienten von 1,77 ausgeschieden. In unveränderter Form wird der Wirkstoff nur in Spuren eliminiert. Die Gesamtclearance der biologischen Substanz Mirena aus dem Blutplasma beträgt 1 ml pro Minute und Kilogramm Körpergewicht. Die Halbwertszeit beträgt etwa 1 Tag.
Hinweise zur Verwendung
- Empfängnisverhütung;
- idiopathische Menorrhagie;
- vorbeugende Behandlung Endometriumhyperplasie beim Austausch Hormontherapie.
Mirena-Spirale - Kontraindikationen
Absolute Kontraindikationen für die Verwendung von Hormonspiralen:
- Schwangerschaft ;
- entzündliche Erkrankungen der Organe Becken;
- nach der Geburt ;
- Infektionsprozess in den unteren Teilen des Urogenitalsystems;
- Vorgeschichte septischer Abtreibungen in den letzten drei Monaten;
- maligne Neoplasien Gebärmutter oder Gebärmutterhals;
- weibliches Fortpflanzungssystem;
- Uterusblutung unbekannter Herkunft;
- hormonabhängige Tumorneoplasien;
- angeborene oder erworbene Anomalien der anatomischen und histologische Struktur Uterus;
- akute Lebererkrankungen;
- erhöht Empfindlichkeit zu den pharmakologischen Komponenten des Intrauterinpessars.
Pathologische Zustände, die die Verwendung eines Intrauterinpessars erschweren können Levonorgestrel :
- postpartale Periode von 48 Stunden bis 4 Wochen;
- tiefe Venenthrombose;
- gutartige trophoblastische Erkrankung ;
- Brustkrebs gegenwärtig oder in der Geschichte innerhalb der letzten 5 Jahre;
- hohe Wahrscheinlichkeit Infektionskrankheiten sexuell übertragbare Krankheiten;
- aktive Lebererkrankung (z scharf , dekompensiert und so weiter).
Nebenwirkungen von Mirena
Veränderungen des Menstruationszyklus
Nebenwirkungen des IUP sollten mit beginnen Veränderungen in der Art und Zyklizität der Menstruationsblutung , weil sie deutlich häufiger auftreten als andere Nebenwirkungen therapeutischer Maßnahmen. So verlängert sich die Dauer der Blutung bei 22 % der Frauen und es kommt zu einer unregelmäßigen Gebärmutter Blutungen beobachtet in 67 %, wenn man die ersten 90 Tage nach der Installation des Mirena-Medikaments berücksichtigt. Die Häufigkeit dieser Phänomene nimmt allmählich ab, da die Hormonspirale mit der Zeit weniger biologisch aktive Substanzen freisetzt und am Ende des ersten Jahres 3 % bzw. 19 % beträgt. Allerdings nimmt die Häufigkeit anderer Erkrankungen zu Menstruationszyklus– bis zum Ende des ersten Jahres tritt bei 16 % auf und ist selten Blutung bei 57 % der Patienten.
Andere Nebenwirkungen
- Von außen Immunsystem : Hautausschlag Und , , .
- Von außen Nervensystem : Kopfschmerzen, , deprimierte Stimmung bis zu .
- Nebenwirkungen von Fortpflanzungssystem und Milchdrüsen: Vulvovaginitis , Ausfluss aus dem Genitaltrakt, Beckeninfektionen, , Schmerzen in den Brustdrüsen, Vertreibung Intrauterinpessar, , Perforation der Gebärmutter.
- Von außen Magen-Darm-Trakt : Bauchschmerzen, Übelkeit.
- Dermatologische Erkrankungen: , , .
- Von außen Herz-Kreislauf-System: erhöhter Blutdruck.
Mirena-Intrauterinpessar: Gebrauchsanweisung (Methode und Dosierung)
Allgemeine Bestimmungen zur Verwendung des Arzneimittels
Das Verhütungsmittel Mirena wird direkt in die Gebärmutterhöhle gespritzt und entfaltet dort seine Wirkung pharmakologische Wirkungen für 5 Jahre. Release-Geschwindigkeit Die aktive Hormonkomponente beträgt zu Beginn der Anwendung des Intrauterinpessars 20 µg pro Tag und sinkt nach 5 Jahren allmählich auf einen Wert von 10 µg pro Tag. Durchschnittliche Eliminierungsrate Levonorgestrel Während des gesamten Therapieverlaufs beträgt die Dosis etwa 14 µg pro Tag.
Es gibt eine Besonderheit Indikator für die Wirksamkeit von Verhütungsmitteln , was die Anzahl der Schwangerschaften bei 100 Frauen während der Anwendung eines Verhütungsmittels widerspiegelt. Bei korrekter Installation und Einhaltung aller Regeln für die Verwendung des Intrauterinpessars: Perlenindex für Mirena beträgt für 1 Jahr etwa 0,2 %, für 5 Jahre sind es 0,7 %, was die unglaublich hohe Wirksamkeit dieser Verhütungsmethode zum Ausdruck bringt (zum Vergleich: Kondome haben einen Pearl-Index von 3,5 % bis 11 %, und y Chemikalien Art der Spermizide – von 5 % bis 11 %).
Die Installation und Entfernung des intrauterinen Systems kann damit einhergehen schmerzhafte Empfindungen Unterleib, mäßige Blutung. Außerdem kann die Manipulation bei Patienten zu Ohnmachtsanfällen aufgrund einer vaskulär-vagalen Reaktion oder einem Krampfanfall führen Daher kann die Anwendung einer Lokalanästhesie der weiblichen Geschlechtsorgane erforderlich sein.
Vor der Installation des Arzneimittels
Es wird empfohlen, das IUP zu platzieren einziger Arzt , der Erfahrung mit dieser Art der Empfängnisverhütung hat, da zwingend aseptische Bedingungen und entsprechende medizinische Kenntnisse erforderlich sind weibliche Anatomie und arbeiten Arzneimittel. Unmittelbar vor der Installation ist eine Durchführung erforderlich allgemein und gynäkologische Untersuchung , um die Risiken einer weiteren Verwendung des Verhütungsmittels auszuschließen, das Vorhandensein Schwangerschaft und Krankheiten, die als Kontraindikationen wirken.
Der Arzt muss die Lage der Gebärmutter und die Größe ihrer Höhle bestimmen, da die richtige Lage des Mirena-Systems eine gleichmäßige Wirkung der aktiven Komponente gewährleistet Endometrium , was die Voraussetzungen für seine maximale Effizienz schafft.
Anleitung für Mirena für medizinisches Personal
Stellen Sie den Gebärmutterhals mit einem gynäkologischen Spekulum dar und behandeln Sie ihn und die Vagina mit antiseptischen Lösungen. Erfassen Oberlippe Begradigen Sie den Gebärmutterhalskanal mit einer Pinzette und sanftem Zug und sichern Sie diese Position der medizinischen Instrumente bis zum Ende der Manipulation zur Installation des Intrauterinpessars. Bewegen Sie die Uterussonde langsam durch die Organhöhle zum Fundus der Gebärmutter und bestimmen Sie parallel dazu die Richtung des Gebärmutterhalskanals und die genaue Tiefe der Höhle, wobei mögliche anatomische Septen, Synechien, submuköse Fibrome oder andere Hindernisse ausgeschlossen werden. Wenn der Gebärmutterhalskanal eng ist, wird empfohlen, ihn mit einer Lokalanästhesie oder einer Leitungsanästhesie zu erweitern.
Überprüfen Sie die sterile Verpackung mit dem Medikament auf Unversehrtheit, öffnen Sie sie und entnehmen Sie das Intrauterinpessar. Bewegen Sie den Schieber in die äußerste Position, sodass das System in das Leiterrohr hineingezogen wird und das Aussehen eines kleinen Stäbchens annimmt. Halten Sie den Schieber in der gleichen Position und stellen Sie die Oberkante des Indexrings entsprechend dem zuvor gemessenen Abstand zum Uterusfundus ein. Schieben Sie den Führungsdraht vorsichtig durch den Gebärmutterhalskanal, bis der Ring etwa 1,5 bis 2 cm vom Gebärmutterhals entfernt ist.
Nachdem Sie die gewünschte Position der Spirale erreicht haben, bewegen Sie den Schieber langsam, bis die horizontalen Arme vollständig geöffnet sind, und warten Sie 5–10 Sekunden, bis das System eine T-Form annimmt. Schieben Sie den Führungsdraht in die Fundalposition vor, erkennbar am vollständigen Kontakt des Indexrings mit dem Gebärmutterhals. Während Sie den Leiter in dieser Position halten, geben Sie das Medikament über die unterste Position des Schiebers ab. Entfernen Sie vorsichtig den Leiter. Schneiden Sie die Fäden ausgehend vom äußeren Muttermund auf eine Länge von 2-3 cm ab.
Es wird empfohlen, die korrekte Position des Intrauterinpessars unmittelbar nach der Installation von Mirena mittels Ultraschall zu bestätigen. Eine erneute Untersuchung wird nach 4-12 Wochen und dann einmal im Jahr durchgeführt. Wenn klinisch angezeigt, gynäkologische Untersuchung und Überprüfung der korrekten Position der Spirale Funktionelle Methoden Eine Labordiagnostik sollte regelmäßig durchgeführt werden.
Entfernen des Intrauterinpessars
Mirena sollte entfernt werden nach 5 Jahren nach der Installation, da die Wirksamkeit des Therapeutikums nach diesem Zeitraum deutlich nachlässt. IN medizinische Literatur Es wurden sogar Fälle beschrieben, in denen die nachteilige Wirkung eines nicht rechtzeitig entfernten Intrauterinpessars mit der Entwicklung entzündlicher Erkrankungen der Beckenorgane und einiger anderer pathologischer Zustände einherging.
Zu extrahieren Das Medikament erfordert die strikte Einhaltung aseptischer Bedingungen. Bei der Entfernung der Mirena erfolgt ein vorsichtiges Ziehen der mit einer speziellen gynäkologischen Pinzette erfassten Fäden. Wenn die Fäden nicht sichtbar sind und sich das Intrauterinpessar tief in der Organhöhle befindet, kann ein Zughaken verwendet werden. Möglicherweise ist auch eine Erweiterung des Gebärmutterhalskanals erforderlich.
Nach dem Entfernen Beim Mirena-Präparat sollte das System auf seine Unversehrtheit überprüft werden, da sich in manchen Situationen der Hormon-Elastomer-Kern lösen oder auf die Schultern des T-förmigen Körpers rutschen kann. Beschrieben pathologische Fälle, wenn solche Komplikationen bei der Entfernung eines Intrauterinpessars einen zusätzlichen gynäkologischen Eingriff erforderten.
Überdosis
Bei richtiger Anwendung und Einhaltung aller Regeln für die Platzierung eines Intrauterinpessars kann es zu einer Überdosis eines Arzneimittels kommen unmöglich .
Interaktion
Pharmazeutische Enzyminduktoren, insbesondere biologische Katalysatoren aus dem System Cytochrom P 450 , die am metabolischen Abbau von Arzneimitteln beteiligt sind, wie z Antikonvulsiva ( , Phenytoin , ) Und ( und andere), fördern die biochemische Transformation Gestagene . Ihr Einfluss auf die Wirksamkeit von Mirena ist jedoch unbedeutend, da der Hauptanwendungspunkt der therapeutischen Fähigkeiten des Intrauterinpessars die lokale Wirkung auf das Endometrium ist.
Verkaufsbedingungen
Erhältlich in Apothekenkiosken auf Rezept.
Lagerbedingungen
Intrauterin Hormonspirale sollten in steriler Verpackung außerhalb der Reichweite von Kindern aufbewahrt werden jüngeres Alter ein Ort, der vor direkter Sonneneinstrahlung geschützt ist Sonnenstrahlen. Richtig Temperaturregime sollte 30 Grad Celsius nicht überschreiten.
Haltbar bis
Besondere Anweisungen
Mirena-Hormongerät für Uterusmyome
(andere Namen - Myome oder Leiomyom ) ist ein gutartiger Tumor, der aus der Muskelschicht der Gebärmutter (Myometrium) wächst und eine der häufigsten gynäkologischen Erkrankungen ist. Pathologischer Schwerpunkt ist ein Knoten aus chaotisch verwobenen glatten Muskelfasern von mehreren Millimetern bis mehreren Zentimetern. Zur Behandlung dieser nosologischen Einheit wird sie in der Regel verwendet Operation Mittlerweile wurde jedoch ein konservatives Behandlungsschema entwickelt.
Das Medikament der Wahl ist hormonelle Wirkstoffe mit bevorzugt lokaler Typ Interaktion, daher ist das Mirena-Intrauterinpessar eine Art Goldstandard für die Sanierung von Uterusmyomen.
Antiöstrogene Wirkung Ziel ist es, die Größe pathologischer Knoten zu verkleinern, möglichen Komplikationen vorzubeugen und das Volumen chirurgischer Eingriffe zu reduzieren, um die maximale physiologische Struktur der Gebärmutter zu erhalten und zukünftige Schwangerschaften zu ermöglichen.
Mirena-Spirale bei Endometriose
– ein pathologischer Zustand, bei dem die Zellen der inneren Gebärmutterschicht außerhalb der Gebärmutter wachsen. Histologische Strukturen verfügen über Rezeptoren für weibliche Sexualhormone, die die gleichen Veränderungen wie im normalen Endometrium hervorrufen, die sich in monatlichen Blutungen äußern und als Reaktion darauf eine Entzündungsreaktion entwickeln.
Gynäkologische Erkrankungen kommen bei Frauen häufig vor Fortpflanzungsalter und außerdem schmerzhafte Empfindungen, kann zu einer häufigen Komplikation der Endometriose führen, weshalb es so wichtig ist, den pathologischen Zustand rechtzeitig zu diagnostizieren und die Behandlung richtig anzugehen. Selbstverständlich kann die Therapie der Endometriose eine Operation mit minimalinvasivem Vorgehen umfassen eine kleine Menge Aufgrund der Nebenwirkungen ist jedoch die Wahl konservativer Behandlungsmethoden weitaus vorzuziehen.
Intrauterinpessar Mirena – wirksames Mittel Endometriose aus mehreren Gründen zu beseitigen:
- bewiesen praktische Forschung die Wirkung des Arzneimittels, die sich in einer Hemmung des Wachstums pathologischer Herde, einer Verringerung ihrer Größe und einer allmählichen Resorption äußert;
- weniger Nebenwirkungen im Vergleich zu anderen Arzneimitteln;
- Schmerzlinderung ist unerlässlich begleitend zum Problem Endometriose;
- Es besteht keine Notwendigkeit, täglich orale Tabletten oder Injektionen einzunehmen.
- Normalisierung des Menstruationszyklus;
- Es besteht keine Notwendigkeit zur Empfängnisverhütung.
Intrauterinpessar für Endometriumhyperplasie
Endometriumhyperplasie – Dieser pathologische Zustand ist der Endometriose sehr ähnlich, da er ein übermäßiges Wachstum und eine Verdickung der Schleimhaut der weiblichen Geschlechtsorgane darstellt. Der Unterschied liegt in der korrekten anatomischen Lage der histologischen Strukturen, die lediglich die Symptome verändert und mögliche Komplikationen, wird sie aber nicht los.
Die nosologische Einheit ist an starken und anhaltenden Blutungen während der Menstruation oder im Uterus zu erkennen Blutungen nicht mit dem Zyklus zusammenhängen, fehlender Eisprung und die Unfähigkeit, den Embryo in die veränderte Gebärmutterschleimhaut einzupflanzen, was eine Manifestation ist erhöhtes NiveauÖstrogen im Körper. Die ätiologische Behandlung dieses Problems, die auf die Beseitigung der unmittelbaren Ursache abzielt, sind hormonelle Wirkstoffe mit ausgeprägter antiöstrogener Wirkung.
Die meisten Gynäkologen bevorzugen aufgrund seiner Zuverlässigkeit die Verwendung des Mirena-Intrauterinsystems pharmakologische Wirkung, einfache Alltagsanwendung, die keine zusätzlichen medizinischen Kenntnisse erfordert und im Vergleich zu anderen Therapeutika relativ günstig ist, da die Verwendung von Mirena keine alltäglichen Kosten für orale Tabletten oder Injektionen mit sich bringt.
Schwangerschaft nach Anwendung des Intrauterinpessars Mirena
Da das Verhütungsmittel überwiegend lokale pharmakologische Wirkungen hat, ist dies vollständig Wiederherstellung aller physiologischen Indikatoren Nach Absetzen des Medikaments tritt es recht schnell auf. Innerhalb eines Jahres nach der Evakuierung des Systems erreicht die Häufigkeit geplanter Schwangerschaften 79,1–96,4 %. Der histologische Zustand des Endometriums ist nach 1–3 Monaten wiederhergestellt und der Menstruationszyklus ist innerhalb von 30 Tagen vollständig wiederhergestellt und normalisiert.
Analoga
Es gibt mehrere Arzneimittel mit demselben ATC-Code und ähnlicher Wirkstoffzusammensetzung: Jaydess , , Evadir Allerdings kann nur Jaydess zu Recht als Analogon bezeichnet werden, da das Medikament durch ein intrauterines System repräsentiert wird, das darauf basiert Levonorgestrel mit einer geringeren Dosierung und daher für eine nur dreijährige Daueranwendung ausgelegt.
Mit Alkohol
Das pharmazeutische Präparat hat eine ausgeprägte Lokalwirkung therapeutische Wirkung und gelangt in geringen Mengen in den Körperkreislauf weiblicher Körper, interagiert daher nicht mit den Bestandteilen alkoholischer Getränke, ihre dosierte Anwendung wird jedoch empfohlen, um keine anderen Nebenwirkungen oder nachteiligen Folgen zu verursachen.
Während der Schwangerschaft und Stillzeit
Die Verwendung des Intrauterinpessars Mirena ist kontraindiziert Schwangerschaft oder Verdacht darauf, da irgendjemand intrauterines Kontrazeptivum erhöht das Risiko spontane Abtreibung Und Frühgeburt. Das Entfernen oder Sondieren des Systems kann auch zu einer ungeplanten Evakuierung des Fötus aus der Gebärmutterhöhle führen. Wenn eine sorgfältige Entfernung des Verhütungsmittels nicht möglich ist, sollte gegebenenfalls die Angemessenheit eines medizinischen Schwangerschaftsabbruchs besprochen werden.
Wenn eine Frau ihre Schwangerschaft fortsetzen möchte, sollte die Patientin zunächst umfassend über die möglichen Risiken und nachteiligen Folgen für ihren Körper und das Kind aufgeklärt werden. Zukünftig sollten Sie den Schwangerschaftsverlauf sorgfältig überwachen und durch zuverlässige Diagnosemethoden eine Eileiterimplantation unbedingt ausschließen.
Wegen lokale Anwendung hormonelles Verhütungsmittel Es gibt eine Möglichkeit virilisierende Wirkung auf den Fötus , jedoch aufgrund hohe effizienz Arzneimittel Mirena, klinische Erfahrung hinsichtlich des Schwangerschaftsausgangs bei gleichzeitiger Anwendung eines Intrauterinpessars sind sehr begrenzt. Darüber sollte auch eine Frau informiert werden, die ihre Schwangerschaft fortsetzen möchte.
Stillen stellt keine Kontraindikation für die Anwendung des intrauterinen Systems dar, obwohl während der Stillzeit geringe Mengen des Wirkstoffs (ca. 0,1 % der Dosis) in die Milch übergehen können. Es ist unwahrscheinlich, dass solch geringe Mengen Levonorgestrel irgendwelche pharmakologischen Auswirkungen auf das Kind haben. Die medizinische Gemeinschaft stimmt mit überwältigender Mehrheit darin überein, dass das Medikament verwendet wird in 6 Wochen Nach der Geburt hat es keine negativen Auswirkungen auf das Wachstum und die Entwicklung des jungen Körpers.
Allgemeine Merkmale
Therapeutisches intrauterines System Mirena als intrauterines Kontrazeptivum (IUC)
Therapeutisches intrauterines System (hormonelles intrauterines System, hormonell Intrauterinpessar, Marine) Mirena bezieht sich auf intrauterin hormonelle Verhütungsmittel.In den 60er und 70er Jahren erschienen kupferhaltige VMCs, deren Effizienz noch höher war. Das Problem der Metrorrhagie (Uterusblutung) wurde jedoch durch die zweite Generation intrauteriner Kontrazeptiva nicht gelöst.
Und schließlich erschienen in der zweiten Hälfte der 70er Jahre die ersten hormonhaltigen intrauterinen Kontrazeptiva – die neue, dritte Generation von Spiralen. Daten medizinische Versorgung Kombinieren Sie die positiven Aspekte von IUP und hormoneller oraler Gabe Verhütungsmittel.
Hormonhaltige intrauterine Kontrazeptiva sind wirksamer als andere Empfängnisverhütung diese Gruppe. Darüber hinaus führen sie nicht zu Gebärmutterblutungen. Durch die Anwendung hormonhaltiger intrauteriner Kontrazeptiva werden die Menstruationsblutungen weniger stark.
Beschreibung der Darreichungsform
Das intrauterine Hormonsystem Mirena verfügt über einen T-förmigen Körper, der eine stabile Platzierung in der Gebärmutterhöhle gewährleistet. An einem Ende hat der Körper eine Schlaufe, an der Fäden befestigt sind, um das System zu entfernen. Auf dem Körper befindet sich ein hormoneller Elastomerkern, bei dem es sich um eine weiße oder fast weiße Substanz handelt Weiß. Der Kern ist mit einer durchscheinenden Membran bedeckt, die den Fluss des Wirkstoffs in die Gebärmutterhöhle reguliert.Die aktive Hormonsubstanz des Systems – das Gestagen-Medikament Levonorgestrel – wird in einer Menge von 52 mg angeboten. Der Hilfsstoff ist Polydimethylsiloxan-Elastomer.
Das intrauterine Hormonsystem von Mirena befindet sich im Hohlraum des Führungsrohrs. Der Leiter und der Körper des Arzneimittels weisen keine Verunreinigungen auf.
Jede Packung Mirena enthält ein intrauterines Hormonsystem, das in einer Vakuumhülle aus Kunststoff und Papier untergebracht ist.
Erworben Darreichungsform Vor der Anwendung sollte Mirena an einem vor Sonnenlicht geschützten Ort bei Raumtemperatur (15–30 Grad) aufbewahrt werden. Die Haltbarkeit beträgt drei Jahre.
Stoffwechsel des Wirkstoffs im Körper
Das hormonelle Mirena-IUP beginnt unmittelbar nach der Platzierung in der Gebärmutterhöhle mit der Freisetzung von Levonorgestrel. Die Freisetzungsrate des Wirkstoffs beträgt nach der Verabreichung 20 µg/Tag, bis zum Ende des fünften Jahres sinkt sie auf 10 µg/Tag.Die Verbreitung von Levonorgestrol charakterisiert vorwiegend Mirena als Medikament lokale Aktion. Die höchste Konzentration der Substanz wird im Endometrium (der Gebärmutterschleimhaut) gespeichert. Im Myometrium (in der Muskelschicht) erreicht die Konzentration von Levonorgestrel kaum 1 % der Konzentration im Endometrium. Die Konzentration von Levonorgestrel im Blutplasma ist 1000-mal geringer als im Endometrium.
Der Wirkstoff gelangt etwa eine Stunde nach Verabreichung des Systems ins Blut. Die maximale Konzentration von Levonorgestrel im Blutserum wird nach zwei Wochen erreicht.
Das Körpergewicht beeinflusst maßgeblich die Konzentration des Wirkstoffs im Blutplasma. Bei Frauen mit reduziertem Gewicht (37-54 kg) ist die Konzentration von Levonorgestrol im Blut im Durchschnitt eineinhalbfach höher.
Der Wirkstoff wird nahezu vollständig in der Leber metabolisiert (abgebaut) und über die Nieren und den Darm ausgeschieden.
Funktionsprinzip
Die wichtigsten empfängnisverhütenden Wirkungen des intrauterinen Hormonsystems von Mirena beruhen auf einer schwachen lokalen Reaktion auf einen Fremdkörper in der Gebärmutterhöhle und überwiegend auf dem lokalen Einfluss des Gestagen-Arzneimittels Levonorgestrol.Es kommt zur Unterdrückung funktionelle Aktivität Epithel der Gebärmutterhöhle: gehemmt normale Höhe Endometrium, die Aktivität seiner Drüsen nimmt ab, es kommt zu Veränderungen in der Submukosa – all diese Veränderungen verhindern letztendlich die Einnistung einer befruchteten Eizelle.
Andere wichtige empfängnisverhütende Wirkung ist eine Erhöhung der Viskosität des von den Drüsen des Gebärmutterhalses abgesonderten Schleims und eine Verdickung der Schleimhaut des Gebärmutterhalskanals, die das Eindringen von Spermien in die Gebärmutterhöhle verhindert.
Darüber hinaus hemmt Mirena die Beweglichkeit der Spermien in der Gebärmutterhöhle und den Eileitern.
In den ersten Monaten der Anwendung kann es aufgrund der Umstrukturierung der Gebärmutterschleimhaut zu unregelmäßigen Schmierblutungen kommen. Eine weitere Unterdrückung der Proliferation des Endometriumepithels führt jedoch zu einer deutlichen Abnahme des Volumens und der Dauer der Menstruationsblutung bis hin zur Amenorrhoe (Ausbleiben der Menstruation).
Hinweise zur Verwendung
 Das intrauterine Hormonsystem von Mirena soll in erster Linie eine ungewollte Schwangerschaft verhindern.
Das intrauterine Hormonsystem von Mirena soll in erster Linie eine ungewollte Schwangerschaft verhindern. Darüber hinaus wird das Medikament bei übermäßig starken Menstruationsblutungen unbekannter Ursache eingesetzt (sofern die Möglichkeit einer Krebserkrankung im weiblichen Genitalbereich ausgeschlossen ist).
Als lokales Gestagen-Medikament wird das Mirena-Intrauterinpessar zur Vorbeugung einer Endometriumhyperplasie (Proliferation) während einer Östrogenersatztherapie eingesetzt (diese Art der Behandlung ist nach Operationen zur Entfernung beider Eierstöcke sowie in schweren Wechseljahren angezeigt).
Kontraindikationen
Mirena ist ein intrauterines Verhütungsmittel und daher streng kontraindiziert bei entzündlichen Erkrankungen des weiblichen Genitalbereichs, wie zum Beispiel:- akute und chronische entzündliche Erkrankungen der Beckenorgane;
- infektiöse Läsionen des unteren Urogenitaltrakts;
- postpartale Endometritis;
- septischer Abort, der weniger als drei Monate vor der Installation erfolgte.
Als intrauterines Kontrazeptivum ist Mirena auch bei zervikaler Dysplasie, bösartigen Neubildungen des Körpers und des Gebärmutterhalses sowie angeborenen oder erworbenen Veränderungen in der Konfiguration der Gebärmutterhöhle (einschließlich Myomen) kontraindiziert.
Da der Wirkstoff des Arzneimittels in der Leber metabolisiert wird, ist das intrauterine Hormonsystem von Mirena bei onkologischen Erkrankungen dieses Organs sowie bei akuter Hepatitis und Zirrhose kontraindiziert. Wenn zuvor eine Gelbsucht unbekannter Ursache aufgetreten ist, sollte das Medikament mit großer Vorsicht angewendet werden.
Da es sich bei Levonorgestrol um ein Gestagen-Medikament handelt, ist Mirena bei allen gestagenabhängigen Erkrankungen kontraindiziert. onkologische Erkrankungen(hauptsächlich bei Brustkrebs).
Die systemische Wirkung von Levonorgestrol auf den Körper einer Frau ist schwach. Allerdings sollte das intrauterine Hormonsystem von Mirena in Fällen, in denen Gestagen-Medikamente kontraindiziert sind, mit äußerster Vorsicht angewendet werden. Dies gilt insbesondere für schwere Durchblutungsstörungen (Herzinfarkt, Schlaganfall), schwere Migräneattacken in der Vorgeschichte (auch solche, die auf schwere Erkrankungen hinweisen können). Gehirnkreislauf), arterielle Hypertonie, schwere Formen Diabetes mellitus, Thrombophlebitis und Neigung zu thromboembolischen Komplikationen.
In solchen Fällen ist der Grad des Risikos (die Schwere der Krankheitssymptome) entscheidend relative Kontraindikation zur Verschreibung des Arzneimittels) und die Vorteile seiner Anwendung. Die Frage der Verwendung von Mirena wird in Absprache mit einem Fachmann und während der Verwendung der Spirale ständig entschieden ärztliche Aufsicht und Laborkontrolle.
Mirena ist während der Schwangerschaft (diagnostiziert oder vermutet) und bei Überempfindlichkeit gegen die Bestandteile des Arzneimittels kontraindiziert.
Nebenwirkungen
Häufige Nebenwirkungen
 Zu den häufigen Nebenwirkungen gehören: damit verbundene Symptome, die nicht seltener als bei jedem hundertsten und nicht häufiger als bei jedem zehnten Patienten auftritt, der eine Spirale verwendet.
Zu den häufigen Nebenwirkungen gehören: damit verbundene Symptome, die nicht seltener als bei jedem hundertsten und nicht häufiger als bei jedem zehnten Patienten auftritt, der eine Spirale verwendet. Bei Frauen, die Mirena anwenden, sind die häufigsten Symptome: unangenehme Symptome aus dem Zentralnervensystem, wie zum Beispiel: Nervosität, Reizbarkeit, Schlechte Laune, verminderte Libido, Kopfschmerzen.
Aus dem Magen-Darm-Trakt plagen Patienten häufig Bauchschmerzen, Übelkeit und Erbrechen.
Zu den häufigsten negativen Auswirkungen auf das Aussehen zählen Akne und Gewichtszunahme.
Patienten klagen häufig über den Zustand des Fortpflanzungssystems und der Brustdrüsen: Schmerzen im Beckenbereich, Schmierblutungen, Vulvovaginitis, Verspannungen und Schmerzen Milchdrüsen.
Rückenschmerzen, die einem Ischias ähneln, kommen relativ häufig vor.
Alle oben beschriebenen Symptome sind in den ersten Monaten der Anwendung der Mirena-Spirale am stärksten ausgeprägt, danach nimmt ihre Intensität ab, und zwar in den allermeisten Fällen unangenehme Anzeichen völlig verschwinden.
Seltene Nebenwirkungen
Zu den seltenen Nebenwirkungen gehören Begleitsymptome Konsum des Arzneimittels, der nicht häufiger als bei jedem hundertsten Patienten und nicht seltener als bei jedem tausend Patienten auftritt.Zu den seltenen Nebenwirkungen von Mirena gehören:
- emotionale Labilität ( häufige Schichtwechsel Stimmung);
- das Auftreten von Ödemen;
- Alopezie (Kahlheit);
- Hirsutismus (verstärkte Behaarung);
- Juckreiz der Haut;
Sehr seltene Nebenwirkungen
Zu den sehr seltenen Nebenwirkungen von Mirena (weniger als eine von tausend) gehören: allergische Reaktionen in Form von Hautausschlag und Urtikaria. Treten solche Anzeichen auf, sollten andere mögliche Ursachen für Hautallergien ausgeschlossen und ggf. die Spirale nicht mehr verwendet werden.Gebrauchsanweisung
Installation des Intrauterinpessars Mirena
 Die sterile Vakuumverpackung wird unmittelbar vor der Installation des Systems geöffnet. Ein vorzeitig geöffnetes System muss als zerstört werden medizinischer Abfall.
Die sterile Vakuumverpackung wird unmittelbar vor der Installation des Systems geöffnet. Ein vorzeitig geöffnetes System muss als zerstört werden medizinischer Abfall.Nur ein Arzt mit ausreichender Erfahrung in der Durchführung dieser Art von Manipulation kann das Mirena-Intrauterinsystem installieren.
Bevor Sie die Mirena-Spirale installieren, sollten Sie einen Gynäkologen konsultieren und sich über alle Risiken und möglichen Nebenwirkungen informieren.
Nach der Entscheidung, das Mirena-IUP einzusetzen, muss sich eine Frau einer Brustuntersuchung und Mammographie sowie einer gynäkologischen Untersuchung einschließlich einer Unterleibsuntersuchung und Kolposkopie (oder zumindest einem Abstrich vom Gebärmutterhals) unterziehen.
Es ist notwendig, onkologische Pathologien der weiblichen Geschlechtsorgane, Schwangerschaft und sexuell übertragbare Infektionen auszuschließen. Alles entzündlich gynäkologische Erkrankungen sollte zum Zeitpunkt der Installation vollständig ausgehärtet sein.
Vor der Installation der Mirena-Spirale ist es äußerst wichtig, die Lage der Gebärmutter im Becken sowie die Größe und Konfiguration der Gebärmutterhöhle zu bestimmen. Die korrekte Platzierung des IUP in der Gebärmutterhöhle garantiert die Wirksamkeit des Mirena-Systems und verhindert dessen Ausstoß (Ausstoß).
Frauen gebärfähiges Alter Mirena wird in den ersten sieben Tagen des Menstruationszyklus eingesetzt.
Wenn nicht medizinische Kontraindikationen, Das Mirena-IUP kann unmittelbar nach einem künstlichen oder spontanen Abort im ersten Schwangerschaftstrimester eingesetzt werden.
ZU chirurgischer Eingriff werden äußerst selten kontaktiert.
Amenorrhoe Amenorrhoe bezieht sich auf häufige Komplikationen mit der Mirena-Spirale. In der Regel entwickelt es sich in den ersten sechs Monaten der Anwendung eines Verhütungsmittels schleichend.
Amenorrhoe bezieht sich auf häufige Komplikationen mit der Mirena-Spirale. In der Regel entwickelt es sich in den ersten sechs Monaten der Anwendung eines Verhütungsmittels schleichend.
Wenn die Menstruationsblutung verschwindet, sollte eine Schwangerschaft ausgeschlossen werden (Routinetest durchführen). Wenn der Test negativ ausfällt, müssen Sie ihn in Zukunft nicht mehr wiederholen. Der normale Menstruationszyklus wird nach der Entfernung von Mirena wieder aufgenommen.
Entfernen der Spirale
Nach 5 Jahren Gebrauch sollte die Mirena-Spule entfernt werden. In Fällen, in denen eine Frau nach der Entfernung des IUP beabsichtigt, die Verhütungsmaßnahmen fortzusetzen, sollte die Mirena-Spirale zu Beginn des Menstruationszyklus entfernt werden. Wenn das IUP in der Mitte des Zyklus entfernt wird und zuvor ungeschützter Geschlechtsverkehr stattgefunden hat, besteht für die Frau ein echtes Risiko, schwanger zu werden.Möchte eine Frau die Spirale weiterhin verwenden, kann direkt nach der Entfernung eine neue Spirale eingesetzt werden. In Fällen, in denen nach der Entfernung des IUP sofort ein neues intrauterines Verhütungsmittel installiert wird, können Manipulationen zu jedem Zeitpunkt des Zyklus durchgeführt werden.
Nach dem Entfernen des Mirena-IUP sollten Sie die Unversehrtheit der Spirale überprüfen, da bei Schwierigkeiten beim Entfernen des Produkts manchmal die Substanz in die Gebärmutterhöhle rutscht.
Das Einsetzen und Entfernen der Mirena-Spule kann mit unterschiedlich starken Schmerzen und Blutungen einhergehen. In manchen Fällen kann es zu Ohnmachtsanfällen kommen. Bei Frauen mit Epilepsie kann das Einsetzen oder Entfernen des IUP einen Anfall verursachen.
Mirena-Intrauterinpessar und Schwangerschaft
Das Medikament ist sehr wirksam. In Fällen, in denen ungewollte Schwangerschaft Kommt es dennoch zu einer Eileiterschwangerschaft, sollte zunächst eine Eileiterschwangerschaft ausgeschlossen werden. Bei intrauterine Schwangerschaft Es stellt sich die Frage nach seiner Unterbrechung.Entscheidet sich eine Frau, das Kind zu behalten, wird das IUP vorsichtig aus der Gebärmutterhöhle entfernt. In Fällen, in denen eine Entfernung des intrauterinen Systems nicht möglich ist, wird die Frau vor den möglichen Risiken einer Schwangerschaft mit einem IUP in der Gebärmutterhöhle (spontaner vorzeitiger Schwangerschaftsabbruch) gewarnt.
Möglich nachteiliger Einfluss Medikament für die Entwicklung des Fötus. Aufgrund der hohen empfängnisverhütenden Eigenschaften des Arzneimittels gibt es nur sehr wenige Fälle, in denen ein Kind mit dem intrauterinen Mirena-System ausgetragen wird. Es wird jedoch empfohlen, dass die Frau über klinische Daten zum Auftreten fetaler Pathologien unter dem Einfluss informiert wird dieses Medikament NEIN.
Anwendung während der Stillzeit
 Der Wirkstoff der Mirena-Spirale dringt in geringen Konzentrationen in das Blutplasma ein und kann während der Stillzeit freigesetzt werden, sodass der Gehalt an Levonorgestrel in der Muttermilch etwa 0,1 % der Tagesdosis der vom System ausgeschiedenen Substanz beträgt.
Der Wirkstoff der Mirena-Spirale dringt in geringen Konzentrationen in das Blutplasma ein und kann während der Stillzeit freigesetzt werden, sodass der Gehalt an Levonorgestrel in der Muttermilch etwa 0,1 % der Tagesdosis der vom System ausgeschiedenen Substanz beträgt. Es ist unwahrscheinlich, dass eine solche Dosis den Allgemeinzustand des Babys beeinträchtigen könnte. Experten sagen, dass die Anwendung von Mirena während der Stillzeit sechs Wochen nach der Geburt für ein gestilltes Baby völlig sicher ist.
Häufig gestellte Fragen
Die Kosten für Mirena sind ziemlich hoch. Ich habe gehört, dass die Verwendung des IUP mit vielen unangenehmen Nebenwirkungen einhergeht. Gibt es eine positive Wirkung des Arzneimittels auf den Körper?
Das intrauterine Hormonsystem von Mirena hat die folgenden therapeutischen (nicht empfängnisverhütenden) Wirkungen:- Verringerung des Volumens und der Dauer von Uterusblutungen (idiopathisch – d. h. nicht durch eine begleitende Pathologie verursacht);
- erhöhte Hämoglobinwerte;
- Normalisierung des Eisenstoffwechsels im Körper;
- allgemeine stärkende Wirkung);
- Linderung der Schmerzen während der schmerzhaften Menstruation;
- Vorbeugung von Endometriose und Uterusmyomen;
- Prävention von Endometriumhyperplasie und Krebs.
Ist es möglich, die Mirena-Spule bei Myomen zur Behandlung des Tumors einzusetzen?
Das Mirena-Therapiesystem hemmt das Wachstum des Myom-Tumorknotens. Allerdings ist eine zusätzliche Untersuchung und Rücksprache mit einem Arzt erforderlich. Viel hängt von der Größe der Knoten und ihrem Standort ab. Beispielsweise handelt es sich um submuköse Myomknoten, die die Konfiguration der Gebärmutterhöhle verändern absolute Kontraindikation zur Verwendung des Mirena-IUP.Hilft die Mirena-Spirale bei Endometriose?
Das intrauterine System schüttet ein Hormon in die Gebärmutterhöhle aus, das die Proliferation des Endometriums hemmt – dies ist die Grundlage für die Fähigkeit der Mirena-Spirale, die Entwicklung einer Endometriose zu verhindern.IN letzten Jahren Es sind Werke erschienen, die darauf hinweisen therapeutische Wirkung Mirena-Spulen gegen Endometriose. Klinische Daten sind recht widersprüchlich. Darüber hinaus ist zu beachten, dass die Behandlung der Endometriose mit Hormonspiralen nicht in allen Ländern angewendet wird.
Aus Sicht der evidenzbasierten Medizin kann die Mirena-Spirale bei Endometriose wie jede andere Hormontherapie nur vorübergehende Ergebnisse bringen. Die russischen nationalen Leitlinien für Gynäkologie empfehlen, mit zu beginnen chirurgische Behandlung, als das radikalste.
Im Einzelfall ist jedoch eine gründliche Untersuchung und Konsultation mit Ärzten – Gynäkologen, Chirurgen und Endokrinologen – erforderlich.
Meine Periode hörte sechs Monate nach der Einführung der Mirena-Spirale vollständig auf. Das ist in Ordnung? Kann ich nach der IUP-Entfernung schwanger werden?
Amenorrhoe (Ausbleiben der Menstruation) ist eine normale Reaktion des Körpers auf die Wirkung des Mirena-Hormonsystems, die bei jeder fünften Frau auftritt, die das IUP verwendet. Typischerweise entwickelt sich dieser Zustand allmählich.Beim ersten Verschwinden Monatsblutung Eine Schwangerschaft sollte ausgeschlossen werden. Die Wirksamkeit des Medikaments ist sehr hoch, Experten empfehlen dennoch einen Test. Bei einem negativen Testergebnis besteht in Zukunft kein Grund zur Sorge. Nach dem Entfernen der Mirena-Spirale wird die Menstruation wiederhergestellt und eine normale Schwangerschaft kann erwartet werden.
Sind Schmerzen, Ausfluss oder Uterusblutungen nach dem Einsetzen des Mirena-IUP möglich?
Unmittelbar nach der Mirena-Installation, geringfügig Schmerzsyndrom und Spotting. Starke Schmerzen und Blutungen können auf eine unsachgemäße Installation des IUP hinweisen. In diesem Fall muss die Mirena-Spule entfernt werden.Schmerzen, Ausfluss oder Uterusblutungen längere Zeit nach der Installation der Mirena-Spule können auf den Beginn einer Austreibung (Ausstoß des Arzneimittels aus der Gebärmutterhöhle) oder einer Eileiterschwangerschaft hinweisen. Daher sollten Sie beim Auftreten solcher Symptome sofort einen Arzt aufsuchen.
Beeinflusst Mirena das Gewicht? Ich möchte unbedingt ein Mirena-Intrauterinpessar kaufen, habe aber Angst, meine Form zu verlieren (ich neige zu Übergewicht).
Gewichtszunahme ist eine ziemlich häufige unangenehme Nebenwirkung der Mirena-Spirale. Allerdings sollte man bedenken, dass nicht jeder dick wird. Klinischen Daten zufolge bemerken mindestens neun von zehn Frauen nach dem Einsetzen eines IUP nicht einmal eine leichte Gewichtszunahme.Darüber hinaus ist Gewichtszunahme eine der Nebenwirkungen von Mirena, die in den ersten Monaten nach der Installation am stärksten ausgeprägt ist. In der Regel verschwindet in Zukunft die durch das Hormonpräparat verursachte Tendenz zur Gewichtszunahme.
Aufgrund der bestehenden Tendenz zu Übergewicht kann man die Möglichkeit einer Gewichtszunahme nach der Installation der Mirena-Spirale nicht beurteilen, da das Auftreten dieser Nebenwirkung und der Schweregrad von der individuellen Reaktion auf das Hormonpräparat abhängt.
Ich habe mich mit hormonellen Medikamenten geschützt. Es gibt keine Nebenwirkungen, aber ich vergesse oft, Tabletten einzunehmen. Wie kann ich am besten von Tablets auf Mirena umsteigen?
Bei unregelmäßiger Einnahme der Pillen besteht ein mögliches Risiko einer Schwangerschaft, das bei der Verordnung der Mirena-Spirale ausgeschlossen werden sollte.Darüber hinaus ist eine vollständige gynäkologische Untersuchung (Unterleibsuntersuchung, Kolposkopie) und eine Überprüfung des Zustands der Brustdrüsen erforderlich.
Wenn keine Kontraindikationen für den Einsatz eines IUP bestehen, wird das IUP am besten am vierten bis sechsten Tag des Menstruationszyklus eingesetzt. Am Tag der Installation der Mirena-Spirale werden die Antibabypillen abgesetzt.
Wann kommt es nach der Mirena-Entfernung zu einer Schwangerschaft?
Klinische Daten zeigen, dass 80 % der Frauen mit Kinderwunsch im ersten Jahr nach Entfernung der Mirena-Spirale schwanger werden. Dies liegt sogar geringfügig über dem normalen Fruchtbarkeitsniveau (Fekundität).Natürlich dauert die Genesung einige Zeit normaler Zustand Fortpflanzungssystem, das für jede Frau individuell ist.
Patienten, bei denen eine Schwangerschaft unerwünscht ist, raten Ärzte unmittelbar nach dem Entfernen der Mirena-Spirale, Maßnahmen zur Verhinderung einer Empfängnis zu ergreifen, da bei vielen Frauen die Wahrscheinlichkeit einer Schwangerschaft unmittelbar nach dem Absetzen des Systems besteht.
Wo kann man Mirena-Spirale kaufen?
Das Mirena-Intrauterinpessar kann in der Apotheke gekauft werden. Die Abgabe des Arzneimittels erfolgt nach ärztlicher Verordnung.
Hinweise zur Verwendung
- Empfängnisverhütung
- Idiopathische Menorrhagie
- Vorbeugung einer Endometriumhyperplasie während einer HRT
DIE INFORMATIONEN WERDEN STRENG ZUR VERFÜGUNG GESTELLT
FÜR GESUNDHEITSFACHLEUTE
Mirena - offizielle Anweisungen per Antrag
Registrierungsnummer:
P N014834/01 - 130617Handelsname des Arzneimittels:
Internationaler Freiname:
LevonorgestrelDarreichungsform:
Intrauterines TherapiesystemVerbindung:
Wirkstoff: Levonorgestrel mikronisiert 52 mg
Hilfsstoffe
:
Kern aus Polydimethylsiloxan-Elastomer, Membran aus Polydimethylsiloxan-Elastomer mit kolloidalem, wasserfreiem Siliciumdioxid 30-40 Gew.-%.
Andere Komponenten: T-förmiger Polyethylenkörper mit 20–24 Gew.-% Bariumsulfat, dünner Polyethylenfaden braun, lackiert mit Eisenoxidschwarz<
1,0 % масс.
Liefergerät: Dirigent - 1 Stk. Die Zusammensetzung ist für ein intrauterines therapeutisches System mit Anleitung angegeben.
Beschreibung:
Das Mirena® Intrauterine Therapy System (IUP) ist ein T-förmiges Levonorgestrel-freisetzendes Gerät, das in einem Führungsrohr platziert ist. Die Bestandteile des Führungsdrahtes sind Einführrohr, Kolben, Indexring, Griff und Schieber. Das IUP besteht aus einem weißen oder cremefarbenen hormonellen Elastomerkern, der auf einem T-förmigen Körper sitzt und von einer undurchsichtigen Membran bedeckt ist, die die Freisetzung von Levonorgestrel reguliert. Der T-förmige Körper hat an einem Ende eine Schlaufe und am anderen Ende zwei Arme. An der Schlaufe sind Fäden angebracht, um das System zu entfernen. Das IUP ist frei von sichtbaren Verunreinigungen.Pharmakotherapeutische Gruppe:
GestagenATX-Code:
G02BA03Pharmakologische Eigenschaften
Pharmakodynamik
Das Medikament Mirena® ist ein intrauterines therapeutisches System (IUP), das Levonorgestrel freisetzt und überwiegend lokal gestagen wirkt. Gestagen (Levonorgestrel) wird direkt in die Gebärmutterhöhle freigesetzt, was seinen Einsatz in äußerst geringen Mengen ermöglicht Tagesdosis. Hohe Konzentrationen von Levonorgestrel im Endometrium tragen dazu bei, die Empfindlichkeit seiner Östrogen- und Progesteronrezeptoren zu verringern, wodurch das Endometrium resistent gegen Östradiol wird und eine starke antiproliferative Wirkung hat. Bei der Anwendung des Medikaments Mirena® werden morphologische Veränderungen im Endometrium und eine schwache lokale Reaktion auf das Vorhandensein eines Fremdkörpers in der Gebärmutter beobachtet. Eine Erhöhung der Viskosität des Gebärmutterhalssekrets verhindert das Eindringen von Spermien in die Gebärmutterhöhle, da die Beweglichkeit der Spermien abnimmt und sich die Gebärmutterschleimhaut verändert. Bei manchen Frauen wird der Eisprung unterdrückt. Die vorherige Anwendung von Mirena® hat keinen Einfluss auf die Fortpflanzungsfunktion. Etwa 80 % der Frauen mit Kinderwunsch werden innerhalb von 12 Monaten nach Entfernung des IUP schwanger.
In den ersten Monaten der Anwendung von Mirena® kann es aufgrund der Hemmung der Endometriumproliferation zu einer anfänglichen Zunahme der „Schmierblutbildung“ kommen. blutiger Ausfluss aus der Vagina. Anschließend führt eine ausgeprägte Unterdrückung der Endometriumproliferation zu einer Verringerung der Dauer und des Volumens der Menstruationsblutung bei Frauen, die Mirena® anwenden. Leichte Blutungen gehen häufig in Oligo- oder Amenorrhoe über. Gleichzeitig bleiben die Eierstockfunktion und die Östradiolkonzentration im Blutplasma normal.
Mirena® kann zur Behandlung der idiopathischen Menorrhagie, d.h. Menorrhagie ohne hyperplastische Prozesse im Endometrium (Endometriumkrebs, metastatische Läsionen der Gebärmutter, submuköser oder großer interstitieller myomatöser Knoten, der zu einer Verformung der Gebärmutterhöhle führt, Adenomyose), Endometritis, extragenitale Erkrankungen und Zustände, die mit schwerer Hypokoagulation einhergehen (z. B , von-Willebrand-Krankheit, schwere Thrombozytopenie), deren Symptome Menorrhagie sind. Nach 3-monatiger Anwendung von Mirena® verringert sich der Menstruationsblutverlust bei Frauen mit Menorrhagie um 62–94 % und nach 6-monatiger Anwendung um 71–95 %. Bei einer zweijährigen Anwendung von Mirena® ist die Wirksamkeit des Arzneimittels (Reduktion des Menstruationsblutverlusts) mit chirurgischen Behandlungsmethoden (Ablation oder Resektion des Endometriums) vergleichbar. Ein weniger günstiges Ansprechen auf die Behandlung ist bei Menorrhagie möglich, die durch submuköse Uterusmyome verursacht wird. Durch die Verringerung des Menstruationsblutverlusts wird das Risiko verringert Eisenmangelanämie. Mirena® reduziert die Schwere der Dysmenorrhoe-Symptome.
Die Wirksamkeit von Mirena® bei der Vorbeugung einer Endometriumhyperplasie während einer chronischen Östrogentherapie war sowohl bei oraler als auch bei transdermaler Östrogenverabreichung gleichermaßen hoch.
Pharmakokinetik
Absorption
Nach der Verabreichung des Arzneimittels Mirena® beginnt Levonorgestrel sofort in die Gebärmutterhöhle freigesetzt zu werden, was durch Messungen seiner Konzentration im Blutplasma nachgewiesen wird. Die hohe lokale Exposition des Arzneimittels in der Gebärmutterhöhle, die für die lokale Wirkung von Mirena® auf das Endometrium notwendig ist, sorgt für einen hohen Konzentrationsgradienten in Richtung vom Endometrium zum Myometrium (die Konzentration von Levonorgestrel im Endometrium übersteigt seine Konzentration in das Myometrium um mehr als das Hundertfache) und geringe Konzentrationen Levonorgestrel im Blutplasma (die Konzentration von Levonorgestrel im Endometrium übersteigt seine Konzentration im Blutplasma um mehr als das 1000-fache). Geschwindigkeit der Freisetzung von Levonorgestrel in die Gebärmutterhöhle in vivo anfangs etwa 20 µg pro Tag und nach 5 Jahren sinkt der Wert auf 10 µg pro Tag.
Verteilung
Levonorgestrel bindet unspezifisch an Plasmaalbumin und spezifisch an Sexualhormon-bindendes Globulin (GSP1). Etwa 1–2 % des zirkulierenden Levonorgestrel liegen als freies Steroid vor, während 42–62 % spezifisch an SHBG gebunden sind. Während der Anwendung des Arzneimittels Mirena® nimmt die Konzentration von SHBG ab. Dementsprechend nimmt der mit SHBG assoziierte Anteil während der Anwendungsdauer von Mirena® ab und der freie Anteil zu. Das durchschnittliche scheinbare Verteilungsvolumen von Levonorgestrel beträgt etwa 106 l. Nach der Gabe von Mirena® wird eine Stunde später Levonorgestrel im Blutplasma nachgewiesen. Die maximale Konzentration wird 2 Wochen nach der Verabreichung von Mirena® erreicht. Entsprechend der abnehmenden Freisetzungsrate sinkt die mittlere Plasmakonzentration von Levonorgestrel bei Frauen im gebärfähigen Alter mit einem Körpergewicht über 55 kg von 206 pg/ml (25. – 75. Perzentil: 151 pg/ml – 264 pg/ml), bestimmt nach 6 Monate, bis zu 194 pg/ml (146 pg/ml – 266 pg/ml) nach 12 Monaten und bis zu 131 pg/ml (113 pg/ml – 161 pg/ml) nach 60 Monaten. Es wurde gezeigt, dass Körpergewicht und Plasma-SHBG-Konzentrationen die systemischen Levonorgestrel-Konzentrationen beeinflussen, d. h. Bei geringem Körpergewicht und/oder hohen SHBG-Konzentrationen sind die Levonorgestrel-Konzentrationen höher. Bei Frauen im gebärfähigen Alter mit geringem Körpergewicht (37 – 55 kg) ist die mittlere Konzentration von Levonorgestrel im Blutplasma etwa 1,5-mal höher.
Bei postmenopausalen Frauen, die Mirena® gleichzeitig mit der intravaginalen oder transdermalen Anwendung von Östrogenen anwenden, sinkt die mittlere Konzentration von Levonorgestrel im Blutplasma von 257 pg/ml (25. – 75. Perzentil: 186 pg/ml – 326 pg/ml), bestimmt nach 12 Monate, bis zu 149 pg/ml (122 pg/ml - 180 pg/ml) nach 60 Monaten. Bei gleichzeitiger Anwendung von Mirena® mit oraler Gabe von Östrogenen steigt die Konzentration von Levonorgestrel im Blutplasma, bestimmt nach 12 Monaten, auf ca. 478 pg/ml (25. – 75. Perzentil: 341 pg/ml – 655 pg/ml), was aufgrund der Induktion der SHBG-Synthese.
Biotransformation
Levonorgestrel wird weitgehend metabolisiert. Die Hauptmetaboliten im Blutplasma sind unkonjugierte und konjugierte Formen von 3a, 50-Tetrahydrolevonorgestrel. Basierend auf den Ergebnissen von In-vitro- und In-vivo-Studien ist CYP3A4 das wichtigste Isoenzym, das am Metabolismus von Levonorgestrel beteiligt ist. Die Isoenzyme CYP2E1, CYP2C19 und CYP2C9 können ebenfalls am Metabolismus von Levonorgestrel beteiligt sein, jedoch in geringerem Maße.
Beseitigung
Die gesamte Plasma-Clearance von Levonorgestrel beträgt etwa 1,0 ml/min/kg. Unverändertes Levonorgestrel wird nur in Spuren ausgeschieden. Metaboliten werden über den Darm und die Nieren mit einem Ausscheidungskoeffizienten von etwa 1,77 ausgeschieden. Die Halbwertszeit in der Endphase, die hauptsächlich aus Metaboliten besteht, beträgt etwa einen Tag.
Linearität/Nichtlinearität
Die Pharmakokinetik von Levonorgestrel hängt von der SHBG-Konzentration ab, die wiederum durch Östrogene und Androgene beeinflusst wird. Bei der Anwendung des Arzneimittels Mirena® wurde eine Abnahme der durchschnittlichen SHBG-Konzentration um etwa 30 % beobachtet, was mit einer Abnahme der Levonorgestrel-Konzentration im Blutplasma einherging. Dies weist auf die Nichtlinearität der Pharmakokinetik von Levonorgestrel im Zeitverlauf hin. Aufgrund der vorwiegend lokalen Wirkung von Mirena® ist eine Auswirkung von Veränderungen der systemischen Konzentrationen von Levonorgestrel auf die Wirksamkeit von Mirena® unwahrscheinlich.
Hinweise zur Verwendung
- Empfängnisverhütung.
- Idiopathische Menorrhagie.
- Vorbeugung einer Endometriumhyperplasie während einer Östrogenersatztherapie.
Kontraindikationen
- Schwangerschaft oder Verdacht darauf.
- Akute oder wiederkehrende entzündliche Erkrankungen der Beckenorgane. Infektionen der äußeren Genitalien. Postpartale Endometritis.
- Septischer Abort innerhalb der letzten drei Monate.
- Zervizitis.
- Erkrankungen, die mit einer erhöhten Anfälligkeit für Infektionen einhergehen.
- Zervikale Dysplasie.
- Diagnostiziert oder vermutet bösartige Neubildungen Gebärmutter oder Gebärmutterhals.
- Gestagenabhängige Tumoren, einschließlich Brustkrebs.
- Uterusblutung unbekannter Ätiologie.
- Angeborene oder erworbene Anomalien der Gebärmutter, einschließlich Myomen, die zu einer Verformung der Gebärmutterhöhle führen.
- Akute Lebererkrankungen oder Tumore.
- Überempfindlichkeit gegen die Bestandteile des Arzneimittels.
- Mirena® wurde bei Frauen über 65 Jahren nicht untersucht, daher wird die Anwendung von Mirena® für diese Patientenkategorie nicht empfohlen.
Bei folgenden Erkrankungen sollte Mirena® nach Rücksprache mit einem Spezialisten mit Vorsicht angewendet werden:
- angeborene Herzfehler oder Herzklappenerkrankungen (aufgrund des Risikos einer septischen Endokarditis);
- Diabetes mellitus
- Migräne, fokale Migräne mit asymmetrischem Sehverlust oder anderen Symptomen, die auf eine vorübergehende zerebrale Ischämie hinweisen;
- ungewöhnlich starke Kopfschmerzen;
- Gelbsucht;
- ausgesprochen arterielle Hypertonie;
- schwere Durchblutungsstörungen, einschließlich Schlaganfall und Herzinfarkt.
Anwendung während der Schwangerschaft und Stillzeit
Die Anwendung von Mirena® ist während der Schwangerschaft oder bei Verdacht auf eine Schwangerschaft kontraindiziert.
Eine Schwangerschaft bei Frauen, die Mirena® installiert haben, ist äußerst selten. Fällt das IUP jedoch aus der Gebärmutterhöhle, ist die Frau nicht mehr vor einer Schwangerschaft geschützt und sollte vor der Konsultation eines Arztes andere Verhütungsmethoden anwenden.
Während der Anwendung von Mirena® treten bei manchen Frauen keine Menstruationsblutungen auf. Das Ausbleiben der Menstruation weist nicht zwangsläufig auf eine Schwangerschaft hin. Wenn eine Frau keine Menstruation hat und gleichzeitig andere Schwangerschaftsanzeichen (Übelkeit, Müdigkeit, Brustspannen) vorliegen, ist es notwendig, einen Arzt zur Untersuchung und einem Schwangerschaftstest aufzusuchen. Wenn eine Frau während der Anwendung von Mirena® schwanger wird, wird empfohlen, das IUP zu entfernen, da jedes in situ verbleibende intrauterine Verhütungsmittel das Risiko eines spontanen Aborts, einer Infektion oder einer Frühgeburt erhöht. Das Entfernen von Mirena® oder die Untersuchung der Gebärmutter kann zu einem spontanen Abort führen. Wenn eine sorgfältige Entfernung des intrauterinen Kontrazeptivums nicht möglich ist, sollte die Durchführbarkeit eines medizinischen Schwangerschaftsabbruchs besprochen werden. Wenn eine Frau ihre Schwangerschaft fortsetzen möchte und das IUP nicht entfernt werden kann, sollte die Patientin insbesondere über die Risiken aufgeklärt werden mögliches Risiko septischer Abort im zweiten Schwangerschaftstrimester, postpartale eitrig-septische Erkrankungen, die durch Sepsis kompliziert werden können, septischer Schock Und tödlich, und auch mögliche Konsequenzen Frühgeburt für das Baby.
In solchen Fällen sollte der Schwangerschaftsverlauf sorgfältig überwacht werden. Es ist notwendig, eine Eileiterschwangerschaft auszuschließen. Die Frau sollte darüber aufgeklärt werden, dass sie den Arzt über alle Symptome informieren muss, die auf Schwangerschaftskomplikationen hinweisen, insbesondere über das Auftreten von krampfartigen Schmerzen im Unterbauch, Blutungen oder Schmierblutungen aus der Vagina und eine erhöhte Körpertemperatur.
Das in Mirena® enthaltene Hormon wird in die Gebärmutterhöhle abgegeben. Dies bedeutet, dass der Fötus einer relativ hohen lokalen Konzentration des Hormons ausgesetzt ist, obwohl das Hormon in geringen Mengen über das Blut und die Plazenta in den Fötus gelangt. Wegen intrauterine Anwendung und der lokalen Wirkung des Hormons muss die Möglichkeit einer virilisierenden Wirkung auf den Fötus berücksichtigt werden. Wegen hoch empfängnisverhütende Wirksamkeit Mit Mirena® liegen nur begrenzte klinische Erfahrungen hinsichtlich der Schwangerschaftsausgänge vor. Allerdings sollte die Frau darauf hingewiesen werden, dass zu diesem Zeitpunkt keine Beweise vorliegen Geburtsfehler bedingt durch die Einnahme des Medikaments Mirena® bei Fortsetzung der Schwangerschaft bis zur Entbindung ohne Entfernung des IUP, fehlen.
Das Stillen eines Kindes während der Anwendung von Mirena® ist nicht kontraindiziert. Während des Stillens können etwa 0,1 % der Levonorgestrel-Dosis in den Körper des Kindes gelangen. Es ist jedoch unwahrscheinlich, dass Dosen, die nach dem Einsetzen von Mirena® in die Gebärmutterhöhle gelangen, ein Risiko für das Baby darstellen.
Man geht davon aus, dass die Einnahme von Mirena® sechs Wochen nach der Geburt keine Wirkung hat schädlicher Einflussüber das Wachstum und die Entwicklung des Kindes. Eine Monotherapie mit Gestagenen hat keinen Einfluss auf die Menge und Qualität der Muttermilch. Es wurden seltene Fälle gemeldet Gebärmutterblutung bei Frauen, die Mirena® während der Stillzeit anwenden.
Gebrauchsanweisung und Dosierung
Mirena® wird in die Gebärmutterhöhle injiziert und bleibt fünf Jahre lang wirksam.Die In-vivo-Freisetzungsrate von Levonorgestrel beträgt anfänglich etwa 20 µg pro Tag und sinkt nach fünf Jahren auf etwa 10 µg pro Tag. Die durchschnittliche Freisetzungsrate von Levonorgestrel beträgt bis zu fünf Jahre lang etwa 14 µg pro Tag. Das Mirena® IUP kann bei Frauen angewendet werden, die eine orale oder transdermale Hormonersatztherapie (HRT) erhalten, die nur Östrogen enthält.
Bei korrekter Installation des Mirena®-Arzneimittels gemäß den Anweisungen für die medizinische Anwendung beträgt der Pearl-Index (ein Indikator, der die Anzahl der Schwangerschaften bei 100 Frauen widerspiegelt, die im Laufe des Jahres ein Verhütungsmittel anwenden) etwa 0,2 %. Die kumulative Rate, die die Anzahl der Schwangerschaften bei 100 Frauen widerspiegelt, die 5 Jahre lang Verhütungsmittel anwenden, beträgt 0,7 %.
Gebrauchsanweisung für das Mirena® IUP
Mirena® wird in einer sterilen Verpackung geliefert, die erst unmittelbar vor der Installation des Intrauterinsystems geöffnet wird. Beim Umgang mit einem geöffneten System müssen die aseptischen Regeln beachtet werden. Wenn die Sterilität der Verpackung beeinträchtigt zu sein scheint, sollte das IUP als medizinischer Abfall entsorgt werden. Das aus der Gebärmutter entfernte IUP sollte auf die gleiche Weise behandelt werden, da es Hormonrückstände enthält.
Installation, Entfernung und Austausch des intrauterinen Systems
Es wird empfohlen, Mirena® nur von einem Arzt einzuführen, der Erfahrung mit diesem IUP hat oder in diesem Verfahren gut geschult ist.
Vor der Installation Bei Mirena® sollte eine Frau über die Wirksamkeit, Risiken und Nebenwirkungen dieser Spirale aufgeklärt werden. Es ist notwendig, eine allgemeine und gynäkologische Untersuchung einschließlich der Untersuchung der Beckenorgane und der Brustdrüsen sowie einen Abstrich vom Gebärmutterhals durchzuführen. Schwangerschaften und sexuell übertragbare Krankheiten sollten ausgeschlossen und entzündliche Erkrankungen der Geschlechtsorgane vollständig geheilt werden. Dabei werden die Lage der Gebärmutter und die Größe ihrer Höhle bestimmt. Wenn es notwendig ist, die Gebärmutter vor dem Einsetzen des Mirena® IUP sichtbar zu machen, a Ultraschalluntersuchung(Ultraschall) der Beckenorgane. Nach einer gynäkologischen Untersuchung, a Spezialwerkzeug, dem sogenannten Vaginalspekulum, und behandeln Sie den Gebärmutterhals mit einer antiseptischen Lösung. Mirena® wird dann durch einen dünnen, flexiblen Kunststoffschlauch in die Gebärmutter injiziert. Besonders wichtig ist die korrekte Positionierung von Mirena® im Uterusfundus, was eine gleichmäßige Wirkung des Gestagens auf die Gebärmutterschleimhaut gewährleistet, den Ausstoß des IUP verhindert und die Voraussetzungen für seine maximale Wirksamkeit schafft.
Daher sollten Sie die Anweisungen zur Installation von Mirena® sorgfältig befolgen. Da die Technik zum Einführen verschiedener Spiralen in die Gebärmutter unterschiedlich ist, besondere Aufmerksamkeit verarbeitet werden sollen richtige Technik Installation eines bestimmten Systems.
Eine Frau kann das Einsetzen des Systems spüren, aber es sollte sie nicht stören starke Schmerzen. Vor dem Einsetzen kann bei Bedarf eine örtliche Betäubung des Gebärmutterhalses durchgeführt werden.
In einigen Fällen kann es bei Patienten zu einer Stenose des Gebärmutterhalskanals kommen. Bei der Verabreichung von Mirena® an solche Patienten sollte keine übermäßige Kraft angewendet werden. Nach dem Einsetzen des IUP werden manchmal Schmerzen, Schwindel, Schweißausbrüche und Blässe beobachtet. Haut. Frauen wird empfohlen, sich nach der Einnahme von Mirena® einige Zeit auszuruhen. Wenn diese Phänomene nach einer halben Stunde in ruhiger Position nicht verschwinden, ist es möglich, dass das intrauterine System falsch positioniert ist. Es sollte eine gynäkologische Untersuchung durchgeführt werden; Bei Bedarf wird das System entfernt. Bei manchen Frauen führt die Anwendung von Mirena® zu allergischen Hautreaktionen.
Die Frau sollte 4–12 Wochen nach der Installation erneut untersucht werden, und dann einmal im Jahr oder bei klinischer Indikation auch öfter.
Bei Frauen im gebärfähigen Alter sollte Mirena® innerhalb von sieben Tagen nach Beginn der Menstruation in die Gebärmutterhöhle eingeführt werden. Mirena® kann an jedem Tag des Menstruationszyklus durch ein neues IUP ersetzt werden. Eine Spirale kann auch unmittelbar nach einem Schwangerschaftsabbruch im ersten Schwangerschaftstrimester eingesetzt werden, sofern keine entzündlichen Erkrankungen der Geschlechtsorgane vorliegen.
Die Verwendung eines IUP wird für Frauen mit einer Vorgeschichte von mindestens einer Geburt empfohlen.
Installation des Mirena® IUP in Zeit nach der Geburt sollte erst nach vollständiger Rückbildung der Gebärmutter, frühestens jedoch 6 Wochen nach der Geburt, durchgeführt werden. Bei längerer Subinvolution ist es notwendig, eine postpartale Endometritis auszuschließen und die Entscheidung zur Gabe von Mirena® aufzuschieben, bis die Rückbildung abgeschlossen ist. Bei Schwierigkeiten beim Einführen des IUP und/oder sehr starken Schmerzen oder Blutungen während oder nach dem Eingriff sollte umgehend eine gynäkologische Untersuchung und Ultraschall durchgeführt werden, um eine Perforation auszuschließen.
Zur Vorbeugung einer Endometriumhyperplasie während einer HRT mit Arzneimitteln, die nur Östrogen enthalten, kann Mirena® jederzeit bei Frauen mit Amenorrhoe verschrieben werden; Bei Frauen mit anhaltender Menstruation erfolgt die Installation in den letzten Tagen der Menstruationsblutung oder „Entzugsblutung“.
Löschen Mirena® durch vorsichtiges Ziehen an den mit einer Pinzette gefassten Fäden entfernen. Wenn die Fäden nicht sichtbar sind und sich das System in der Gebärmutterhöhle befindet, kann es mithilfe eines Zughakens entfernt werden, um das IUP zu entfernen. Dies kann eine Erweiterung des Gebärmutterhalskanals erfordern.
Das System sollte fünf Jahre nach der Installation entfernt werden. Wenn eine Frau die gleiche Methode weiterhin anwenden möchte, neues System kann sofort nach dem Entfernen des vorherigen installiert werden.
Wenn bei Frauen im gebärfähigen Alter eine weitere Empfängnisverhütung erforderlich ist, sollte die Entfernung des IUP während der Menstruation erfolgen, sofern der Menstruationszyklus aufrechterhalten wird. Wenn das System mitten im Zyklus entfernt wird und eine Frau in der Woche davor Geschlechtsverkehr hatte, besteht für sie das Risiko, schwanger zu werden, es sei denn, sofort nach der Entfernung des alten Systems wird ein neues System installiert.
Das Einsetzen und Entfernen des IUP kann mit Schmerzen und Blutungen einhergehen. Der Eingriff kann aufgrund einer vasovagalen Reaktion, Bradykardie usw. zu Synkopen führen Beschlagnahme Patienten mit Epilepsie, insbesondere wenn eine Veranlagung für diese Erkrankungen besteht oder im Falle einer Stenose des Gebärmutterhalskanals.
Nach dem Entfernen von Mirena® sollte das System auf Unversehrtheit überprüft werden. Wenn es Schwierigkeiten beim Entfernen des IUP gab, Einzelfälle Gleiten des hormonellen Elastomerkerns auf den horizontalen Armen des T-förmigen Körpers, wodurch diese im Kern verschwinden. Sobald die Integrität des IUP bestätigt ist, ist in dieser Situation kein zusätzlicher Eingriff erforderlich.
Stopper an den horizontalen Armen verhindern normalerweise, dass sich der Kern vollständig vom T-Körper löst.
Weitere Informationen für einige Patientengruppen
Kinder und Jugendliche
Mirena® ist nur nach Einsetzen der Menarche (Einstellung des Menstruationszyklus) indiziert.
Ältere Patienten
Mirena® wurde bei Frauen über 65 Jahren nicht untersucht, daher wurde die Anwendung des Arzneimittels nicht untersucht
Mirena® wird für diese Patientenkategorie nicht empfohlen.
Mirena® ist kein Mittel der ersten Wahl für postmenopausale Frauen unter 65 Jahren mit schwerer Uterusatrophie.
Patienten mit Lebererkrankungen
Mirena® ist bei Frauen kontraindiziert akute Erkrankungen oder Lebertumoren (siehe auch Abschnitt „Gegenanzeigen“).
Patienten mit Nierenerkrankungen
Mirena® wurde bei Patienten mit eingeschränkter Nierenfunktion nicht untersucht.
Nebenwirkung
Bei den meisten Frauen ändert sich nach der Installation von Mirena® die Art der zyklischen Blutung. Während der ersten 90 Tage der Anwendung von Mirena® stellen 22 % der Frauen eine Verlängerung der Blutungsdauer fest unregelmäßige Blutung Bei 67 % der Frauen beobachtet, sinkt die Häufigkeit dieser Phänomene bis zum Ende des ersten Jahres der Anwendung auf 3 % bzw. 19 %. Gleichzeitig kommt es in den ersten 90 Tagen der Anwendung bei 0 % der Patienten zu einer Amenorrhoe und bei 11 % der Patienten zu seltenen Blutungen. Bis zum Ende des ersten Nutzungsjahres steigt die Häufigkeit dieser Ereignisse auf 16 % bzw. 57 %.Wenn Mirena® in Kombination mit einer langfristigen Östrogenersatztherapie angewendet wird, kommt es bei den meisten Frauen im ersten Jahr der Anwendung zu einem allmählichen Stillstand der zyklischen Blutung.
Die Tabelle zeigt Daten zur Häufigkeit unerwünschter Arzneimittelwirkungen, die bei der Anwendung von Mirena® gemeldet wurden. Nach Häufigkeit des Auftretens unerwünschte Reaktionen(NR) werden unterteilt in sehr häufig (> 1/10), häufig (von > 1/100 bis<1/10), нечастые (от >1/1000 bis<1/100), редкие (от >1/10.000 bis<1/1000) и с неизвестной частотой. В таблице НР представлены по классам системы органов согласно MedDRA. Данные по частоте отражают приблизительную частоту возникновения НР, зарегистрированных в ходе клинических исследований препарата Мирена® по показаниям «контрацепция» и «идиопатическая меноррагия» с участием 5091 женщин. НР, о которых сообщалось в ходе клинических исследований препарата Мирена® по показанию «профилактика гиперплазии эндометрия при проведении заместительной терапии эстрогенами» (с участием 514 женщин), наблюдались с той же частотой, за исключением случаев, обозначенных сносками (*, **).
| System-Orgel-Klasse | Sehr oft | Oft | Ungewöhnlich | Selten | Häufigkeit unbekannt |
| Störungen des Immunsystems | Überempfindlichkeit gegen das Arzneimittel oder einen Bestandteil des Arzneimittels, einschließlich Hautausschlag, Urtikaria und Angioödem | ||||
| Psychische Störungen | Deprimierte Stimmung, Depression | ||||
| Störungen des Nervensystems | Kopfschmerzen | Migräne | |||
| Magen-Darm-Erkrankungen | Bauchschmerzen/Beckenschmerzen | Brechreiz | |||
| Erkrankungen der Haut und des Unterhautgewebes | Akne Hirsutismus |
Alopezie Juckreiz Ekzem Hyperpigmentierung der Haut |
|||
| Erkrankungen des Bewegungsapparates und des Bindegewebes | Rückenschmerzen** | ||||
| Erkrankungen der Geschlechtsorgane und der Brust | Veränderungen des Blutverlusts, einschließlich Zunahme und Abnahme der Blutungsintensität, Schmierblutung, Oligomenorrhoe und Amenorrhoe Vulvovaginitis* Ausfluss aus dem Genitaltrakt* |
Infektionen der Beckenorgane Eierstockzysten Dysmenorrhoe Schmerzen in den Brustdrüsen* * Brustschwellung Vertreibung IUP (vollständig oder teilweise) |
Uterusperforation (einschließlich Penetration)*** | ||
| Labor- und Instrumentendaten | Bluthochdruck |
** „Sehr häufig“ für die Indikation „Vorbeugung einer Endometriumhyperplasie während einer Östrogenersatztherapie.“
***Diese Häufigkeit basiert auf Daten aus klinischen Studien, an denen stillende Frauen nicht beteiligt waren. In einer großen, prospektiven, vergleichenden, nicht-interventionellen Kohortenstudie mit Frauen, die Spiralen verwenden, wurde eine Uterusperforation bei stillenden Frauen oder bei denen vor der 36. Woche nach der Geburt ein IUP eingesetzt wurde, als „ungewöhnlich“ gemeldet (siehe Abschnitt „Vorsichtsmaßnahmen“).
In den meisten Fällen wird eine MedDRA-konforme Terminologie verwendet, um bestimmte Reaktionen, ihre Synonyme und damit verbundenen Zustände zu beschreiben.
Weitere Informationen
Wenn eine Frau während der Einnahme von Mirena® schwanger wird, erhöht sich das relative Risiko einer Eileiterschwangerschaft. Der Partner kann die Fäden beim Geschlechtsverkehr spüren.
Das Brustkrebsrisiko bei der Anwendung von Mirena® in der Indikation „Vorbeugung einer Endometriumhyperplasie während einer Östrogenersatztherapie“ ist nicht bekannt. Fälle von Brustkrebs wurden gemeldet (Häufigkeit unbekannt, siehe Vorsichtsmaßnahmen und Vorsichtsmaßnahmen).
Die folgenden unerwünschten Ereignisse wurden im Zusammenhang mit der Installation oder Entfernung von Mirena® berichtet: Schmerzen während des Eingriffs, Blutungen während des Eingriffs, vasovagale Reaktion im Zusammenhang mit der Installation, begleitet von Schwindel oder Ohnmacht. Der Eingriff kann bei Patienten mit Epilepsie einen Anfall hervorrufen.
Infektion
Fälle von Sepsis (einschließlich Sepsis durch Streptokokken der Gruppe A) wurden nach dem Einsetzen des IUP berichtet (siehe Abschnitt „Besondere Anweisungen“).
Überdosis
Nicht zutreffend.Wechselwirkung mit anderen Medikamenten
Der Metabolismus von Gestagenen kann durch die gleichzeitige Anwendung von Substanzen, die Enzyminduktoren sind, insbesondere von Cytochrom-P450-Isoenzymen, die am Metabolismus von Arzneimitteln wie Antikonvulsiva (z. B. Phenobarbital, Phenytoin, Carbamazepin) und Arzneimitteln zur Behandlung von Infektionen (z. B B. Rifampicin, Rifabutin, Nevirapin, Efavirenz). Der Einfluss dieser Medikamente auf die Wirksamkeit von Mirena® ist nicht bekannt, es wird jedoch angenommen, dass er nicht signifikant ist, da Mirena® hauptsächlich eine lokale Wirkung hat.Besondere Anweisungen
Vor der Installation von Mirena® sollten pathologische Prozesse in der Gebärmutterschleimhaut ausgeschlossen werden, da in den ersten Monaten der Anwendung häufig unregelmäßige Blutungen/Schmierblutungen beobachtet werden. Pathologische Prozesse im Endometrium sollten auch ausgeschlossen werden, wenn nach Beginn einer Östrogenersatztherapie bei einer Frau, die weiterhin das zuvor zur Empfängnisverhütung verschriebene Medikament Mirena® einnimmt, eine Blutung auftritt. Auch wenn es während einer Langzeitbehandlung zu unregelmäßigen Blutungen kommt, müssen entsprechende diagnostische Maßnahmen ergriffen werden.Mirena® wird nicht zur postkoitalen Empfängnisverhütung eingesetzt.
Mirena® sollte bei Frauen mit angeborener oder erworbener Herzklappenerkrankung mit Vorsicht angewendet werden, wobei das Risiko einer septischen Endokarditis zu berücksichtigen ist. Beim Einsetzen oder Entfernen eines IUP sollten diesen Patienten prophylaktisch Antibiotika verabreicht werden.
Levonorgestrel kann in niedrigen Dosen die Glukosetoleranz beeinträchtigen. Daher sollte seine Konzentration im Blutplasma bei Frauen mit Diabetes mellitus, die Mirena® anwenden, regelmäßig überwacht werden. Eine Dosisanpassung von blutzuckersenkenden Arzneimitteln ist in der Regel nicht erforderlich.
Einige Manifestationen einer Polyposis oder eines Endometriumkarzinoms können durch unregelmäßige Blutungen maskiert werden. In solchen Fällen ist eine zusätzliche Untersuchung zur Klärung der Diagnose erforderlich.
Die Anwendung einer intrauterinen Empfängnisverhütung ist bei Frauen nach der Geburt vorzuziehen. Das Mirena®-IUP sollte bei jungen, nicht gebärenden Frauen nicht als Methode der Wahl angesehen werden und sollte nur dann eingesetzt werden, wenn andere wirksame Verhütungsmethoden nicht angewendet werden können. Bei Frauen mit schwerer Uterusatrophie sollte die Mirena®-Spirale in der postmenopausalen Phase nicht als Methode der ersten Wahl in Betracht gezogen werden.
Die verfügbaren Daten deuten darauf hin, dass die Anwendung von Mirena® das Risiko, an Brustkrebs zu erkranken, bei postmenopausalen Frauen unter 50 Jahren nicht erhöht. Aufgrund der begrenzten Daten, die im Rahmen der Studie zu Mirena® für die Indikation „Prävention einer Endometriumhyperplasie während einer Östrogenersatztherapie“ gewonnen wurden, kann das Brustkrebsrisiko bei der Anwendung von Mirena® für diese Indikation weder bestätigt noch widerlegt werden.
Oligo- und Amenorrhoe entwickeln sich bei Frauen im fruchtbaren Alter allmählich, in etwa 57 % bzw. 16 % der Fälle bis zum Ende des ersten Jahres der Anwendung von Mirena®. Bleibt die Menstruation innerhalb von sechs Wochen nach Beginn der letzten Regelblutung aus, sollte eine Schwangerschaft ausgeschlossen werden. Wiederholte Schwangerschaftstests auf Amenorrhoe sind nicht erforderlich, wenn keine anderen Anzeichen einer Schwangerschaft vorliegen. Wenn Mirena® in Kombination mit einer kontinuierlichen Östrogenersatztherapie angewendet wird, entwickeln die meisten Frauen im Laufe des ersten Jahres allmählich eine Amenorrhoe.
Das Führungsrohr trägt dazu bei, Mirena® beim Einführen vor Infektionen zu schützen, und das Mirena®-Einführgerät ist speziell darauf ausgelegt, das Infektionsrisiko zu minimieren. PID bei Frauen, die intrauterine Kontrazeptiva anwenden, wird häufig durch sexuell übertragbare Infektionen verursacht. Es wurde festgestellt, dass es ein Risikofaktor für PID ist, mehrere Sexualpartner für eine Frau oder mehrere Sexualpartner für den Partner einer Frau zu haben. PID kann schwerwiegende Folgen haben: Sie kann die Fortpflanzungsfunktion beeinträchtigen und das Risiko einer Eileiterschwangerschaft erhöhen. Wie bei anderen gynäkologischen oder chirurgischen Eingriffen kann es nach dem Einsetzen eines IUP zu einer schweren Infektion oder Sepsis (einschließlich Sepsis durch Streptokokken der Gruppe A) kommen, obwohl dies äußerst selten vorkommt.
Bei wiederkehrender Endometritis oder PID sowie bei schweren oder akuten Infektionen, die mehrere Tage lang therapieresistent sind, sollte Mirena entfernt werden. Wenn eine Frau anhaltende Schmerzen im Unterbauch, Schüttelfrost, Fieber, Schmerzen beim Geschlechtsverkehr (Dyspareunie), anhaltende oder starke Schmierblutungen/Blutungen aus der Vagina oder eine Veränderung in der Art des Vaginalausflusses hat, sollten Sie sofort Ihren Arzt konsultieren . Starke Schmerzen oder Fieber, die kurz nach dem Einsetzen eines IUP auftreten, können auf eine schwere Infektion hinweisen, die sofort behandelt werden muss. Auch wenn nur einzelne Symptome auf eine mögliche Infektion hinweisen, ist eine bakteriologische Untersuchung und Überwachung angezeigt.
Mögliche Anzeichen einer teilweisen oder vollständigen Austreibung eines IUP sind Blutungen und Schmerzen. Kontraktionen der Gebärmuttermuskulatur während der Menstruation führen manchmal zur Verschiebung des IUP oder sogar zu dessen Ausstoß aus der Gebärmutter, was zum Aufhören der empfängnisverhütenden Wirkung führt. Eine teilweise Austreibung kann die Wirksamkeit von Mirena® verringern. Da Mirena® den Menstruationsblutverlust reduziert, kann ein erhöhter Blutverlust auf einen Ausstoß des IUP hinweisen. Einer Frau wird empfohlen, die Fäden beispielsweise beim Duschen mit den Fingern zu überprüfen. Wenn eine Frau Anzeichen dafür feststellt, dass sich das IUP gelöst hat oder herausfällt, oder die Fäden nicht spüren kann, sollte sie Geschlechtsverkehr vermeiden oder andere Verhütungsmethoden anwenden und so bald wie möglich einen Arzt aufsuchen. Bei einer falschen Lage in der Gebärmutterhöhle muss das IUP entfernt werden. Möglicherweise wird zu diesem Zeitpunkt ein neues System installiert.
Es ist notwendig, der Frau zu erklären, wie sie die Fäden von Mirena® überprüft.
Vor allem beim Einführen kann es zu einer Perforation oder Penetration des IUP-Körpers oder des Gebärmutterhalses kommen, was die Wirksamkeit von Mirena® verringern kann. In diesen Fällen sollte das System entfernt werden. Wenn sich die Diagnose einer Perforation und IUP-Migration verzögert, können Komplikationen auftreten, wie zum Beispiel: Verwachsungen, Peritonitis, Darmverschluss, Darmperforation, Abszesse oder Erosionen benachbarter innerer Organe.
In einer großen prospektiven, vergleichenden, nicht-interventionellen Kohortenstudie mit Frauen, die IUPs verwenden (N=61.448 Frauen), betrug die Perforationsrate 1,3 (95 %-KI: 1,1–1,6) pro 1000 Einführungen in der gesamten Studienkohorte; 1,4 (95 % KI: 1,1 – 1,8) pro 1000 Verabreichungen in der Mirena®-Studienkohorte und 1,1 (95 % KI: 0,7 – 1,6) pro 1000 Verabreichungen in der Studienkohorte mit kupferhaltigen Spiralen. Die Studie zeigte, dass sowohl das Stillen zum Zeitpunkt des Einsetzens als auch das Stillen bis 36 Wochen nach der Geburt mit einem erhöhten Perforationsrisiko verbunden waren (siehe Tabelle 1). Diese Risikofaktoren waren unabhängig von der Art des verwendeten IUP.
Tabelle 1. Perforationsraten pro 1000 Einfügungen und Risikoverhältnisse, geschichtet nach Stillzeit und Zeit nach der Geburt bei der Einfügung (paröse Frauen, gesamte Studienkohorte).
Bei Frauen mit einer festen Fehlstellung der Gebärmutter (Retroversion und Retroflexion) besteht ein erhöhtes Perforationsrisiko beim Einsetzen eines IUP.
Frauen mit einer Vorgeschichte einer Eileiterschwangerschaft, einer Eileiteroperation oder einer Beckeninfektion haben ein höheres Risiko für eine Eileiterschwangerschaft. Die Möglichkeit einer Eileiterschwangerschaft sollte bei Schmerzen im Unterleib in Betracht gezogen werden, insbesondere wenn diese mit dem Ausbleiben der Menstruation einhergehen oder wenn eine Frau mit Amenorrhoe zu bluten beginnt.
Die Inzidenz einer Eileiterschwangerschaft lag in klinischen Studien mit Mirena® bei etwa 0,1 % pro Jahr. In einer großen prospektiven, vergleichenden, nicht-interventionellen Kohortenstudie mit einem Nachbeobachtungszeitraum von einem Jahr betrug die Inzidenz einer Eileiterschwangerschaft unter der Anwendung von Mirena® 0,02 %. Das absolute Risiko einer Eileiterschwangerschaft ist bei Frauen, die Mirena® anwenden, gering. Wenn eine Frau jedoch mit installierter Mirena® schwanger wird, ist die relative Wahrscheinlichkeit einer Eileiterschwangerschaft höher.
Wenn bei einer gynäkologischen Untersuchung die Fäden zur Entfernung des IUP im Gebärmutterhalsbereich nicht nachweisbar sind, muss eine Schwangerschaft ausgeschlossen werden. Die Fäden können in die Gebärmutterhöhle oder den Gebärmutterhalskanal eingezogen werden und werden nach der nächsten Menstruation wieder sichtbar. Ist eine Schwangerschaft ausgeschlossen, lässt sich die Lage der Fäden in der Regel durch sorgfältige Sondierung mit einem geeigneten Instrument bestimmen. Wenn die Fäden nicht erkannt werden können, ist eine Perforation der Gebärmutterwand oder ein Ausstoß des IUP aus der Gebärmutterhöhle möglich. Mithilfe von Ultraschall kann die korrekte Platzierung des Systems bestimmt werden. Wenn dies nicht möglich oder erfolglos ist, wird eine Röntgenuntersuchung verwendet, um die Lokalisation von Mirena® zu bestimmen.
Da die empfängnisverhütende Wirkung von Mirena® hauptsächlich auf seiner lokalen Wirkung beruht, kommt es bei Frauen im fruchtbaren Alter in der Regel zu Ovulationszyklen mit Follikelruptur. Manchmal verzögert sich die Follikelatresie und die Follikelentwicklung kann fortgesetzt werden. Solche vergrößerten Follikel sind klinisch nicht von Ovarialzysten zu unterscheiden. Bei etwa 7 % der Frauen, die Mirena® einnahmen, wurden Eierstockzysten als Nebenwirkung gemeldet. In den meisten Fällen verursachen diese Follikel keine Symptome, manchmal gehen sie jedoch mit Schmerzen im Unterbauch oder beim Geschlechtsverkehr einher.
In der Regel verschwinden Eierstockzysten innerhalb von zwei bis drei Monaten nach der Beobachtung von selbst. Sollte dies nicht der Fall sein, empfiehlt es sich, die Überwachung mittels Ultraschall sowie therapeutische und diagnostische Maßnahmen fortzusetzen. In seltenen Fällen ist ein chirurgischer Eingriff erforderlich.
Bei der Anwendung von Mirena® in Kombination mit Östrogenen müssen zusätzlich die Angaben in der Gebrauchsanweisung des entsprechenden Östrogens berücksichtigt werden.
Nach der Entfernung von Mirena® ist die Fruchtbarkeit der Frau wiederhergestellt.
In Mirena® enthaltene Hilfsstoffe
Die T-förmige Basis von Mirena® enthält Bariumsulfat, das bei der Röntgenuntersuchung sichtbar wird.
Es ist zu beachten, dass Mirena® nicht vor einer HIV-Infektion und anderen sexuell übertragbaren Krankheiten schützt!
Zusätzliche Informationen für Patienten
Regelmäßige Kontrolluntersuchungen
Ihr Arzt sollte Sie 4–12 Wochen nach dem Einsetzen des IUP untersuchen; regelmäßige ärztliche Untersuchungen sind mindestens einmal im Jahr erforderlich.
Konsultieren Sie so schnell wie möglich Ihren Arzt, wenn:
- Sie spüren die Fäden in Ihrer Vagina nicht mehr.
- Man spürt das untere Ende des Systems.
- Du denkst, du bist schwanger.
- Sie verspüren anhaltende Bauchschmerzen, Fieber oder bemerken eine Veränderung Ihres normalen Vaginalausflusses.
- Sie oder Ihr Partner verspüren beim Geschlechtsverkehr Schmerzen.
- Sie bemerken plötzliche Veränderungen in Ihrem Menstruationszyklus (z. B. wenn Sie leichte oder keine Periode hatten und dann ständige Blutungen oder Schmerzen entwickelten oder Ihre Periode übermäßig stark wurde).
- Sie an anderen medizinischen Problemen leiden, wie z. B. Migränekopfschmerzen oder starken wiederkehrenden Kopfschmerzen, plötzlichen Sehstörungen, Gelbsucht, erhöhtem Blutdruck oder anderen Krankheiten oder Zuständen, die in den Abschnitten „Kontraindikationen“ und „Vorsichtsmaßnahmen“ aufgeführt sind.
Ihr Arzt kann das IUP jederzeit problemlos entfernen, woraufhin eine Schwangerschaft möglich ist. Die Entfernung ist in der Regel schmerzlos. Nach der Entfernung von Mirena® wird die Fortpflanzungsfunktion wiederhergestellt.
Wenn eine Schwangerschaft unerwünscht ist, sollte Mirena® spätestens am siebten Tag des Menstruationszyklus entfernt werden. Wenn Mirena® später als am siebten Tag des Zyklus entfernt wird, sollten Sie vor der Entfernung mindestens sieben Tage lang Barrieremethoden zur Empfängnisverhütung (z. B. ein Kondom) anwenden. Wenn bei Ihnen während der Anwendung von Mirena® keine Menstruation auftritt, sollten Sie sieben Tage vor der Entfernung des IUP mit der Anwendung von Barrieremethoden zur Empfängnisverhütung beginnen und diese bis zum Wiedereinsetzen der Menstruation fortsetzen. Sie können auch direkt nach der Entfernung des vorherigen ein neues IUP einsetzen; In diesem Fall sind keine zusätzlichen Maßnahmen zur Schwangerschaftsverhinderung erforderlich.
Wie lange kann Mirena® angewendet werden?
Mirena® schützt fünf Jahre lang vor einer Schwangerschaft, danach sollte es entfernt werden. Wenn Sie möchten, können Sie ein neues IUP installieren, nachdem Sie das alte entfernt haben.
Wiederherstellung der Empfängnisfähigkeit (Ist eine Schwangerschaft nach Absetzen von Mirena® möglich)
Ja, das kannst du. Sobald Mirena® entfernt wurde, beeinträchtigt es Ihre normale Fortpflanzungsfunktion nicht mehr. Nach der Entfernung von Mirena® kann es während des ersten Menstruationszyklus zu einer Schwangerschaft kommen.
Einfluss auf den Menstruationszyklus (Kann Mirena® Ihren Menstruationszyklus beeinflussen)
Mirena® beeinflusst den Menstruationszyklus. Unter seinem Einfluss kann sich die Menstruation verändern und den Charakter eines „Schmierbluts“ annehmen, länger oder kürzer werden, mit mehr oder weniger Blutungen als gewöhnlich auftreten oder ganz ausbleiben.
In den ersten 3–6 Monaten nach der Installation von Mirena® kommt es bei vielen Frauen zusätzlich zur normalen Menstruation zu häufigen Schmierblutungen oder geringen Blutungen. In einigen Fällen werden in diesem Zeitraum sehr starke oder anhaltende Blutungen beobachtet. Wenn Sie diese Symptome bemerken, insbesondere wenn sie nicht verschwinden, informieren Sie Ihren Arzt.
Es ist sehr wahrscheinlich, dass bei der Anwendung von Mirena® die Anzahl der Blutungstage und die Menge des Blutverlusts mit jedem Monat allmählich abnehmen.
Manche Frauen stellen schließlich fest, dass ihre Periode völlig ausbleibt. Da der Blutverlust während der Menstruation bei der Anwendung von Mirena® in der Regel abnimmt, kommt es bei den meisten Frauen zu einem Anstieg des Hämoglobins im Blut.
Nachdem das System entfernt wurde, normalisiert sich der Menstruationszyklus wieder.
Fehlen der Periode (Ist es normal, keine Periode zu haben)
Ja, wenn Sie Mirena® verwenden. Wenn Sie nach der Installation von Mirena® das Verschwinden der Menstruation bemerken, liegt dies an der Wirkung des Hormons auf die Gebärmutterschleimhaut. Es gibt keine monatliche Verdickung der Schleimhaut und wird daher während der Menstruation nicht abgestoßen. Dies bedeutet nicht unbedingt, dass Sie die Wechseljahre erreicht haben oder schwanger sind. Die Konzentration Ihrer eigenen Hormone im Blutplasma bleibt normal.
Tatsächlich kann das Ausbleiben der Periode ein großer Vorteil für das Wohlbefinden einer Frau sein.
Wie können Sie herausfinden, ob Sie schwanger sind?
Eine Schwangerschaft ist bei Frauen, die Mirena® anwenden, unwahrscheinlich, auch wenn sie keine Menstruation haben.
Wenn Sie sechs Wochen lang keine Periode hatten und besorgt sind, machen Sie einen Schwangerschaftstest. Wenn das Ergebnis negativ ist, sind keine weiteren Tests erforderlich, es sei denn, Sie haben andere Anzeichen einer Schwangerschaft, wie Übelkeit, Müdigkeit oder Brustspannen.
Kann Mirena® Schmerzen oder Beschwerden verursachen?
Manche Frauen verspüren in den ersten zwei bis drei Wochen nach dem Einsetzen eines IUP Schmerzen (ähnlich Menstruationsbeschwerden). Wenn Sie starke Schmerzen verspüren oder die Schmerzen länger als drei Wochen nach der Installation des Systems anhalten, wenden Sie sich an Ihren Arzt oder die Gesundheitseinrichtung, in der Sie Mirena® installiert haben.
Beeinflusst Mirena® den Geschlechtsverkehr?
Weder Sie noch Ihr Partner sollten das IUP beim Geschlechtsverkehr spüren. Andernfalls sollte auf Geschlechtsverkehr verzichtet werden, bis Ihr Arzt sicher ist, dass das System in der richtigen Position ist.
Wie viel Zeit sollte zwischen der Installation von Mirena® und dem Geschlechtsverkehr vergehen?
Um Ihrem Körper eine Pause zu gönnen, verzichten Sie am besten 24 Stunden lang auf Geschlechtsverkehr, nachdem Mirena® in die Gebärmutter eingeführt wurde. Allerdings hat Mirena® ab dem Zeitpunkt der Installation eine empfängnisverhütende Wirkung.
Kann ich Tampons verwenden?
Es wird empfohlen, Damenbinden zu verwenden. Wenn Sie Tampons verwenden, sollten Sie diese sehr vorsichtig wechseln, um die Mirena®-Fäden nicht herauszuziehen.
Was passiert, wenn Mirena® spontan die Gebärmutterhöhle verlässt?
Sehr selten kann es während der Menstruation zu einem Ausstoß des IUP aus der Gebärmutterhöhle kommen. Ein ungewöhnlich erhöhter Blutverlust während der Menstruationsblutung kann darauf hinweisen, dass Mirena® durch die Vagina gelangt ist. Auch ein teilweiser Ausstoß des IUP aus der Gebärmutterhöhle in die Vagina ist möglich (Sie und Ihr Partner bemerken dies möglicherweise beim Geschlechtsverkehr). Wenn Mirena® die Gebärmutter ganz oder teilweise verlässt, hört die empfängnisverhütende Wirkung sofort auf.
Welche Anzeichen deuten darauf hin, dass Mirena® vorhanden ist?
Sie können selbst überprüfen, ob die Mirena®-Fäden nach Ende Ihrer Menstruation noch vorhanden sind. Führen Sie nach dem Ende Ihrer Periode Ihren Finger vorsichtig in Ihre Vagina ein und spüren Sie die Fäden am Ende, nahe dem Eingang zur Gebärmutter (Zervix).
Nicht ziehen
Fäden, da Sie Mirena® versehentlich aus der Gebärmutter ziehen könnten. Wenn Sie die Fäden nicht spüren können, konsultieren Sie einen Arzt.
Auswirkungen auf die Verkehrstüchtigkeit von Fahrzeugen und Maschinen
Nicht beobachtet.
Freigabeformular
Intrauterines therapeutisches System, 20 µg/24 Stunden.1 intrauterines Therapiesystem mit Führung wird in einen sterilen Blister aus Polyethylenfolie gelegt, der mit weißem Vliesstoff mit Klebebeschichtung und Polyester (PETG – Polyethylenterephthalat-Glykol oder APET – amorphes Polyethylenterephthalat) beschichtet ist. Der Blister wird zusammen mit der Gebrauchsanweisung in einen Karton gelegt.
Lagerbedingungen
Bei einer Temperatur von nicht mehr als 30 °C lagern.Außerhalb der Reichweite von Kindern aufbewahren.
Ablaufdatum (vor der Verabreichung)
3 Jahre.Geben Sie spätestens das auf der Verpackung angegebene Verfallsdatum ein.
Urlaubsbedingungen
Laut Rezept.Hersteller
Bayer Oy, FinnlandPensiontje 47, 20210 Turku, Finnland
Bayer Oy, Finnland
Pansiontie 47, 20210 Turku, Finnland
Weitere Informationen erhalten Sie unter:
107113 Moskau, 3. Rybinskaya Str., 18, Gebäude 2.
Anwendung
Hinweise zur Einführung
Nur durch einen Arzt mit sterilen Instrumenten installiert.
Mirena® wird zusammen mit dem Führungsdraht in einer sterilen Verpackung geliefert, die vor der Installation nicht geöffnet werden darf.
Nicht erneut sterilisieren. Nur zur einmaligen Verwendung. Verwenden Sie Mirena® nicht, wenn die Innenverpackung beschädigt oder geöffnet ist. Installieren Sie Mirena® nicht, nachdem der auf der Verpackung angegebene Monat und das Jahr abgelaufen sind.
Bitte lesen Sie vor der Installation die Hinweise zur Anwendung von Mirena®.
Vorbereitung auf die Einführung
- Führen Sie eine gynäkologische Untersuchung durch, um Größe und Lage der Gebärmutter zu bestimmen und Anzeichen einer akuten entzündlichen Erkrankung der Geschlechtsorgane, einer Schwangerschaft oder anderer gynäkologischer Kontraindikationen für die Installation von Mirena® auszuschließen.
- Visualisieren Sie den Gebärmutterhals mit Spekulums und reinigen Sie Gebärmutterhals und Vagina vollständig mit einer antiseptischen Lösung.
- Nehmen Sie bei Bedarf die Hilfe eines Assistenten in Anspruch.
- Fassen Sie die vordere Lippe des Gebärmutterhalses mit einer Pinzette an. Begradigen Sie den Gebärmutterhalskanal durch sanften Zug mit einer Pinzette. Die Pinzette sollte sich während der gesamten Verabreichung von Mirena® in dieser Position befinden, um einen sanften Zug des Gebärmutterhalses in Richtung des eingeführten Instruments zu gewährleisten.
- Bewegen Sie die Uterussonde vorsichtig durch die Höhle zum Uterusfundus, bestimmen Sie die Richtung des Gebärmutterhalskanals und die Tiefe der Gebärmutterhöhle (den Abstand vom äußeren Muttermund zum Uterusfundus) und schließen Sie Septen in der Gebärmutterhöhle aus , Synechien und submuköse Myome. Sollte der Zervikalkanal zu eng sein, empfiehlt sich eine Kanalerweiterung und ggf. der Einsatz von Schmerzmitteln/parazervikalen Blockaden.
1. Öffnen Sie die sterile Verpackung (Abbildung 1). Danach sollten alle Manipulationen mit sterilen Instrumenten und sterilen Handschuhen durchgeführt werden.
Abbildung 1

2. Bewegen Sie den Schieber in Pfeilrichtung nach vorne bis zur äußersten Position, um das IUP in das Führungsrohr zurückzuziehen (Abbildung 2).
Abbildung 2

Wichtige Information!
Bewegen Sie den Schieber nicht nach unten, da dies dazu führen kann, dass Mirena® vorzeitig freigesetzt wird. In diesem Fall kann das System nicht wieder im Leiter platziert werden.
3. Halten Sie den Schieber in der äußersten Position und stellen Sie die Oberkante des Indexrings entsprechend dem gemessenen Abstand vom äußeren Muttermund zum Fundus der Gebärmutter ein (Abbildung 3).
Abbildung 3

4. Halten Sie den Schieber weiterhin in seiner äußersten Position und schieben Sie den Führungsdraht vorsichtig durch den Gebärmutterhalskanal und in die Gebärmutter vor, bis der Indexring etwa 1,5 bis 2 cm vom Gebärmutterhals entfernt ist (Abbildung 4).
Abbildung 4

Wichtige Information!
Den Leiter nicht mit Gewalt nach vorne drücken. Bei Bedarf sollte der Gebärmutterhalskanal erweitert werden.
5. Während Sie den Führungsdraht ruhig halten, bewegen Sie den Schieber zur Markierung, um die horizontalen Schultern von Mirena® zu öffnen (Abbildung 5). Warten Sie 5–10 Sekunden, bis die horizontalen Schultern vollständig geöffnet sind.
Abbildung 5

6. Schieben Sie den Führungsdraht vorsichtig nach innen, bis der Indexring den Gebärmutterhals berührt. Mirena® sollte sich nun in der Grundposition befinden (Abbildung 6).
Abbildung 6

7. Halten Sie den Führungsdraht in der gleichen Position und lösen Sie Mirena®, indem Sie den Schieber so weit wie möglich nach unten bewegen (Abbildung 7). Halten Sie den Schieber in der gleichen Position und entfernen Sie vorsichtig den Leiter, indem Sie daran ziehen. Schneiden Sie die Fäden so ab, dass ihre Länge 2-3 cm vom äußeren Muttermund der Gebärmutter entfernt ist.
Abbildung 7

Wichtige Information!
Wenn Sie Zweifel haben, dass das System korrekt installiert ist, überprüfen Sie die Position von Mirena® z. B. mittels Ultraschall oder entfernen Sie ggf. das System und setzen Sie ein neues, steriles System ein. Entfernen Sie das System, wenn es sich nicht vollständig in der Gebärmutterhöhle befindet. Das entfernte System sollte nicht wiederverwendet werden.
Entfernung/Ersatz von Mirena
Bevor Sie Mirena® entfernen/austauschen, lesen Sie bitte die Gebrauchsanweisung von Mirena®.
Durch vorsichtiges Ziehen an den mit einer Pinzette erfassten Fäden wird Mirena® entfernt. (Abbildung 8).
Abbildung 8

Sie können ein IUP sofort installieren, nachdem Sie Ihr altes entfernt haben.
Die Anwendung von Mirena® ist während der Schwangerschaft oder bei Verdacht auf eine Schwangerschaft kontraindiziert.
Eine Schwangerschaft bei Frauen, die Mirena® installiert haben, ist äußerst selten. Fällt das IUP jedoch aus der Gebärmutterhöhle, ist die Frau nicht mehr vor einer Schwangerschaft geschützt und sollte vor der Konsultation eines Arztes andere Verhütungsmethoden anwenden.
Während der Anwendung von Mirena® treten bei manchen Frauen keine Menstruationsblutungen auf. Das Ausbleiben der Menstruation weist nicht zwangsläufig auf eine Schwangerschaft hin. Wenn eine Frau keine Menstruation hat und gleichzeitig andere Schwangerschaftsanzeichen (Übelkeit, Müdigkeit, Brustspannen) vorliegen, ist es notwendig, einen Arzt zur Untersuchung und einem Schwangerschaftstest aufzusuchen.
Wenn bei einer Frau während der Anwendung von Mirena® eine Schwangerschaft auftritt, wird empfohlen, das IUP zu entfernen, weil Jedes an Ort und Stelle belassene intrauterine Verhütungsmittel erhöht das Risiko eines spontanen Aborts und einer Frühgeburt. Das Entfernen von Mirena® oder die Untersuchung der Gebärmutter kann zu einem spontanen Abort führen. Wenn eine sorgfältige Entfernung des intrauterinen Kontrazeptivums nicht möglich ist, sollte die Durchführbarkeit eines medizinischen Schwangerschaftsabbruchs besprochen werden. Wenn eine Frau ihre Schwangerschaft fortsetzen möchte und das IUP nicht entfernt werden kann, sollte die Patientin über das mögliche Risiko eines septischen Aborts im zweiten Schwangerschaftstrimester, postpartaler eitrig-septischer Erkrankungen, die durch Sepsis, septischen Schock und Tod kompliziert werden können, aufgeklärt werden sowie die möglichen Folgen einer Frühgeburt für das Kind. In solchen Fällen sollte der Schwangerschaftsverlauf sorgfältig überwacht werden. Es ist notwendig, eine Eileiterschwangerschaft auszuschließen.
Die Frau sollte darüber aufgeklärt werden, dass sie den Arzt über alle Symptome informieren muss, die auf Schwangerschaftskomplikationen hinweisen, insbesondere über das Auftreten von krampfartigen Schmerzen im Unterbauch, Blutungen oder Schmierblutungen aus der Vagina und eine erhöhte Körpertemperatur.
Das in Mirena® enthaltene Hormon wird in die Gebärmutterhöhle abgegeben. Dies bedeutet, dass der Fötus einer relativ hohen lokalen Konzentration des Hormons ausgesetzt ist, obwohl das Hormon in geringen Mengen über das Blut und die Plazentaschranke in den Fötus gelangt. Aufgrund der intrauterinen Anwendung und der lokalen Wirkung des Hormons muss die Möglichkeit einer virilisierenden Wirkung auf den Fötus in Betracht gezogen werden. Aufgrund der hohen empfängnisverhütenden Wirksamkeit von Mirena® sind die klinischen Erfahrungen hinsichtlich der Schwangerschaftsausgänge bei der Anwendung begrenzt. Die Frau sollte jedoch darauf hingewiesen werden, dass es derzeit keine Hinweise auf angeborene Auswirkungen gibt, die durch die Anwendung von Mirena® verursacht werden, wenn die Schwangerschaft bis zur Geburt andauert, ohne dass das IUP entfernt wird.
Das Stillen eines Kindes während der Anwendung von Mirena® ist nicht kontraindiziert. Während des Stillens können etwa 0,1 % der Levonorgestrel-Dosis in den Körper des Kindes gelangen. Es ist jedoch unwahrscheinlich, dass Dosen, die nach dem Einsetzen von Mirena® in die Gebärmutterhöhle gelangen, ein Risiko für das Baby darstellen.
Es wird angenommen, dass die Anwendung von Mirena® 6 Wochen nach der Geburt keine schädlichen Auswirkungen auf das Wachstum und die Entwicklung des Kindes hat. Eine Monotherapie mit Gestagenen hat keinen Einfluss auf die Menge und Qualität der Muttermilch. Bei Frauen, die Mirena® während der Stillzeit einnahmen, wurden seltene Fälle von Uterusblutungen berichtet.
Fruchtbarkeit
Nach der Entfernung von Mirena® wird die Fruchtbarkeit der Frau wiederhergestellt
Nebenwirkung
Bei den meisten Frauen ändert sich nach der Installation von Mirena® die Art der zyklischen Blutung. Während der ersten 90 Tage der Anwendung von Mirena® stellen 22 % der Frauen eine Verlängerung der Blutungsdauer fest, bei 67 % der Frauen werden unregelmäßige Blutungen beobachtet, die Häufigkeit dieser Phänomene sinkt auf 3 % bzw. 19 % , bis zum Ende des ersten Jahres seiner Nutzung. Gleichzeitig kommt es in den ersten 90 Tagen der Anwendung bei 0 % der Patienten zu einer Amenorrhoe und bei 11 % der Patienten zu seltenen Blutungen. Bis zum Ende des ersten Nutzungsjahres steigt die Häufigkeit dieser Ereignisse auf 16 % bzw. 57 %.
Wenn Mirena® in Kombination mit einer langfristigen Östrogenersatztherapie angewendet wird, stoppen die meisten Frauen die zyklischen Blutungen im ersten Jahr der Anwendung allmählich.
Nachfolgend finden Sie Daten zur Häufigkeit unerwünschter Arzneimittelwirkungen, die bei der Anwendung von Mirena® gemeldet wurden. Bestimmung der Häufigkeit von Nebenwirkungen: sehr häufig (≥1/10), häufig (von ≥1/100 bis Nebenwirkungen, die während klinischer Studien mit Mirena® für die Indikation „Prävention von Endometriumhyperplasie während einer Östrogenersatztherapie“ berichtet wurden (mit der Teilnahme von 514 Frauen) wurden mit der gleichen Häufigkeit beobachtet, mit Ausnahme der durch Fußnoten (*, **) gekennzeichneten Fälle.
Vom Immunsystem: Häufigkeit unbekannt – Überempfindlichkeit gegen das Arzneimittel oder Bestandteile des Arzneimittels, einschließlich Hautausschlag, Urtikaria und Angioödem.
Von der psychischen Seite: oft - depressive Verstimmung, Depression.
Vom Nervensystem: sehr oft - Kopfschmerzen; oft - Migräne.
Aus dem Verdauungssystem: sehr häufig - Bauchschmerzen/Schmerzen im Beckenbereich; oft - Übelkeit.
Von der Haut und dem Unterhautgewebe: häufig - Akne, Hirsutismus; Gelegentlich – Alopezie, Juckreiz, Ekzem.
Vom Bewegungsapparat: häufig - Rückenschmerzen**.
Aus dem Fortpflanzungssystem und den Brustdrüsen: sehr häufig – Veränderungen im Blutverlustvolumen, einschließlich einer Zunahme und Abnahme der Intensität von Blutungen, Schmierblutungen, Oligomenorrhoe, Amenorrhoe, Vulvovaginitis*, Ausfluss aus dem Genitaltrakt*; häufig - Infektionen der Beckenorgane, Eierstockzysten, Dysmenorrhoe, Schmerzen in den Brustdrüsen**, Anschwellen der Brustdrüsen, Ausstoß des IUP (vollständig oder teilweise); selten - Uterusperforation (einschließlich Penetration).
Aus dem Herz-Kreislauf-System: Häufigkeit unbekannt – erhöhter Blutdruck.
* „Häufig“ entsprechend der Indikation „Vorbeugung einer Endometriumhyperplasie während einer Östrogenersatztherapie.“
** „Sehr häufig“ für die Indikation „Prävention einer Endometriumhyperplasie während einer Östrogenersatztherapie.“
In den meisten Fällen wird eine MedDRA-konforme Terminologie verwendet, um bestimmte Reaktionen, ihre Synonyme und damit verbundenen Zustände zu beschreiben.
Weitere Informationen
Wenn eine Frau während der Einnahme von Mirena® schwanger wird, erhöht sich das relative Risiko einer Eileiterschwangerschaft.
Der Partner kann die Fäden beim Geschlechtsverkehr spüren.
Das Brustkrebsrisiko bei der Anwendung von Mirena® für die Indikation „Prävention einer Endometriumhyperplasie während einer Östrogenersatztherapie“ ist nicht bekannt. Fälle von Brustkrebs wurden gemeldet (Häufigkeit unbekannt).
Stillende Frauen wurden nicht in klinische Studien mit Mirena® einbezogen. Gleichzeitig haben große Post-Registrierungsstudien zur Sicherheit von Mirena® ein erhöhtes Risiko einer Uterusperforation während der Stillzeit festgestellt.
Die folgenden Nebenwirkungen wurden im Zusammenhang mit der Installation oder Entfernung von Mirena® berichtet: Schmerzen während des Eingriffs, Blutungen während des Eingriffs, vasovagale Reaktion im Zusammenhang mit der Installation, begleitet von Schwindel oder Ohnmacht. Der Eingriff kann bei Patienten mit Epilepsie einen epileptischen Anfall hervorrufen.
Infektion
Fälle von Sepsis (einschließlich Sepsis durch Streptokokken der Gruppe A) wurden nach dem Einsetzen des IUP berichtet.
Freigabeformular
Ein intrauterines therapeutisches System (IUP) mit einer Freisetzungsrate des Wirkstoffs von 20 µg/24 h besteht aus einem weißen oder fast weißen Hormon-Elastomer-Kern, der auf einem T-förmigen Körper platziert und mit einer undurchsichtigen Membran bedeckt ist, die die Regulierung des Hormons ermöglicht
Wechselwirkung mit anderen Medikamenten
Es ist möglich, den Metabolismus von Gestagenen bei gleichzeitiger Verwendung von Substanzen zu verbessern, die Enzyminduktoren sind, insbesondere Isoenzyme des Cytochrom-P450-Systems, die am Metabolismus von Arzneimitteln wie Antikonvulsiva (z. B. Phenobarbital, Phenytoin, Carbamazepin) und Arzneimitteln beteiligt sind die Behandlung von Infektionen (zum Beispiel Rifampicin, Rifabutin, Nevirapin, Efavirenz). Der Einfluss dieser Medikamente auf die Wirksamkeit von Mirena® ist unbekannt, es wird jedoch angenommen, dass er unbedeutend ist, da Mirena® hauptsächlich eine lokale Wirkung hat.
Bei der Anwendung von Mirena® in Kombination mit Östrogenen müssen zusätzlich die Angaben in der Gebrauchsanweisung des entsprechenden Östrogens berücksichtigt werden
Verbindung
Levonorgestrel 52 mg
Hilfsstoffe: Polydimethylsiloxan-Elastomer – 52 mg
Lagerbedingungen
Das Arzneimittel sollte außerhalb der Reichweite von Kindern, vor Licht geschützt und bei einer Temperatur von nicht mehr als 30 °C gelagert werden.
Überdosis
Bei dieser Verabreichungsmethode ist eine Überdosierung ausgeschlossen
Besondere Anweisungen
Vor der Installation von Mirena® sollten pathologische Prozesse in der Gebärmutterschleimhaut ausgeschlossen werden, da in den ersten Monaten der Anwendung häufig unregelmäßige Blutungen/Schmierblutungen beobachtet werden. Pathologische Prozesse im Endometrium sollten auch ausgeschlossen werden, wenn nach Beginn einer Östrogenersatztherapie bei einer Frau, die weiterhin das zuvor zur Empfängnisverhütung verschriebene Medikament Mirena® einnimmt, eine Blutung auftritt. Auch wenn es während einer Langzeitbehandlung zu unregelmäßigen Blutungen kommt, müssen entsprechende diagnostische Maßnahmen ergriffen werden.
Mirena® wird nicht zur postkoitalen Empfängnisverhütung eingesetzt.
Mirena® sollte bei Frauen mit angeborener oder erworbener Herzklappenerkrankung mit Vorsicht angewendet werden, wobei das Risiko einer septischen Endokarditis zu berücksichtigen ist. Beim Einsetzen oder Entfernen eines IUP sollten diesen Patienten prophylaktisch Antibiotika verabreicht werden.
Levonorgestrel kann in niedrigen Dosen die Glukosetoleranz beeinträchtigen. Daher sollte seine Konzentration im Blutplasma bei Frauen mit Diabetes mellitus, die Mirena® anwenden, regelmäßig überwacht werden. Eine Dosisanpassung von blutzuckersenkenden Arzneimitteln ist in der Regel nicht erforderlich.
Einige Manifestationen einer Polyposis oder eines Endometriumkarzinoms können durch unregelmäßige Blutungen maskiert werden. In solchen Fällen ist eine zusätzliche Untersuchung zur Klärung der Diagnose erforderlich.
Mirena® ist kein Mittel der ersten Wahl für junge Frauen, die noch nie schwanger waren, oder für Frauen nach der Menopause mit schwerer Uterusatrophie.
Die verfügbaren Daten deuten darauf hin, dass die Anwendung von Mirena® das Risiko, an Brustkrebs zu erkranken, bei postmenopausalen Frauen unter 50 Jahren nicht erhöht. Aufgrund der begrenzten Daten, die im Rahmen der Studie zu Mirena® für die Indikation „Prävention einer Endometriumhyperplasie während einer Östrogenersatztherapie“ gewonnen wurden, kann das Brustkrebsrisiko bei der Anwendung von Mirena® für diese Indikation weder bestätigt noch widerlegt werden.
Oligo- und Amenorrhoe
Oligo- und Amenorrhoe entwickeln sich bei Frauen im fruchtbaren Alter allmählich, in etwa 57 % bzw. 16 % der Fälle bis zum Ende des ersten Jahres der Anwendung von Mirena®. Bleibt die Menstruation innerhalb von 6 Wochen nach Beginn der letzten Regelblutung aus, sollte eine Schwangerschaft ausgeschlossen werden. Wiederholte Schwangerschaftstests auf Amenorrhoe sind nicht erforderlich, es sei denn, es liegen andere Anzeichen einer Schwangerschaft vor.
Wenn Mirena® in Kombination mit einer kontinuierlichen Östrogenersatztherapie angewendet wird, entwickeln die meisten Frauen im Laufe des ersten Jahres allmählich eine Amenorrhoe.
Entzündliche Erkrankungen der Beckenorgane
Das Führungsrohr trägt dazu bei, Mirena® beim Einführen vor Infektionen zu schützen, und das Mirena®-Einführgerät ist speziell darauf ausgelegt, das Infektionsrisiko zu minimieren. Entzündliche Erkrankungen der Beckenorgane bei Patienten, die Spiralen verwenden, werden häufig als sexuell übertragbare Krankheiten eingestuft. Es wurde festgestellt, dass mehrere Sexualpartner ein Risikofaktor für Unterleibsinfektionen sind. Entzündliche Erkrankungen des Beckens können schwerwiegende Folgen haben: Sie können die Fortpflanzungsfunktion beeinträchtigen und das Risiko einer Eileiterschwangerschaft erhöhen.
Wie bei anderen gynäkologischen oder chirurgischen Eingriffen kann es nach dem Einsetzen eines IUP zu einer schweren Infektion oder Sepsis (einschließlich Sepsis durch Streptokokken der Gruppe A) kommen, obwohl dies äußerst selten vorkommt.
Bei wiederkehrenden Endometritis oder entzündlichen Erkrankungen der Beckenorgane sowie bei schweren oder akuten Infektionen, die über mehrere Tage therapieresistent sind, sollte Mirena entfernt werden. Wenn eine Frau anhaltende Schmerzen im Unterbauch, Schüttelfrost, Fieber, Schmerzen beim Geschlechtsverkehr (Dyspareunie), anhaltende oder starke Schmierblutungen/Blutungen aus der Vagina oder eine Veränderung in der Art des Vaginalausflusses hat, sollten Sie sofort Ihren Arzt konsultieren . Starke Schmerzen oder Fieber, die kurz nach dem Einsetzen eines IUP auftreten, können auf eine schwere Infektion hinweisen, die sofort behandelt werden muss. Auch wenn nur einzelne Symptome auf eine mögliche Infektion hinweisen, ist eine bakteriologische Untersuchung und Überwachung angezeigt.
Vertreibung
Mögliche Anzeichen einer teilweisen oder vollständigen Austreibung eines IUP sind Blutungen und Schmerzen. Kontraktionen der Gebärmuttermuskulatur während der Menstruation führen manchmal zur Verschiebung des IUP oder sogar zu dessen Ausstoß aus der Gebärmutter, was zum Aufhören der empfängnisverhütenden Wirkung führt. Eine teilweise Austreibung kann die Wirksamkeit von Mirena® verringern. Da Mirena® den Menstruationsblutverlust reduziert, kann ein erhöhter Blutverlust auf einen Ausstoß des IUP hinweisen. Einer Frau wird empfohlen, die Fäden beispielsweise beim Duschen mit den Fingern zu überprüfen. Wenn eine Frau Anzeichen dafür feststellt, dass sich das IUP gelöst hat oder herausfällt, oder die Fäden nicht spüren kann, sollte sie Geschlechtsverkehr vermeiden oder andere Verhütungsmethoden anwenden und so bald wie möglich einen Arzt aufsuchen.
Bei einer falschen Lage in der Gebärmutterhöhle muss das IUP entfernt werden. Möglicherweise wird zu diesem Zeitpunkt ein neues System installiert.
Es ist notwendig, der Frau zu erklären, wie sie die Fäden von Mirena® überprüft.
Perforation und Penetration
Eine Perforation oder Penetration des IUP-Körpers oder des Gebärmutterhalses kommt selten vor, hauptsächlich während der Einführung, und kann die Wirksamkeit von Mirena® verringern. In diesen Fällen sollte das System entfernt werden. Wenn sich die Diagnose einer Perforation und IUP-Migration verzögert, kann es zu Komplikationen wie Verwachsungen, Peritonitis, Darmverschluss, Darmperforation, Abszessen oder Erosionen benachbarter innerer Organe kommen. Bei stillenden Frauen ist das Risiko einer Gebärmutterperforation erhöht. Beim Einsetzen eines IUP nach der Geburt und bei Frauen mit fester Uterusflexion besteht möglicherweise ein erhöhtes Perforationsrisiko.
Eileiterschwangerschaft
Frauen mit einer Vorgeschichte von Eileiterschwangerschaften, Eileiteroperationen oder Beckeninfektionen haben ein höheres Risiko für eine Eileiterschwangerschaft. Die Möglichkeit einer Eileiterschwangerschaft sollte bei Schmerzen im Unterleib in Betracht gezogen werden, insbesondere wenn diese mit dem Ausbleiben der Menstruation einhergehen oder wenn eine Frau mit Amenorrhoe zu bluten beginnt. Die Inzidenz einer Eileiterschwangerschaft bei der Anwendung von Mirena® beträgt etwa 0,1 % pro Jahr. Das absolute Risiko einer Eileiterschwangerschaft ist bei Frauen, die Mirena® anwenden, gering. Wenn jedoch eine Frau mit installierter Mirena® schwanger wird, ist die relative Wahrscheinlichkeit einer Eileiterschwangerschaft höher.
Verlorene Threads
Wenn bei einer gynäkologischen Untersuchung die Fäden zur Entfernung des IUP im Gebärmutterhalsbereich nicht nachweisbar sind, muss eine Schwangerschaft ausgeschlossen werden. Die Fäden können in die Gebärmutterhöhle oder den Gebärmutterhalskanal eingezogen werden und werden nach der nächsten Menstruation wieder sichtbar. Ist eine Schwangerschaft ausgeschlossen, lässt sich die Lage der Fäden in der Regel durch sorgfältige Sondierung mit einem geeigneten Instrument bestimmen. Wenn die Fäden nicht erkannt werden können, ist es möglich, dass das IUP aus der Gebärmutterhöhle ausgestoßen wurde. Um die korrekte Platzierung des Systems zu bestimmen, kann eine Ultraschalluntersuchung durchgeführt werden. Wenn dies nicht möglich oder erfolglos ist, wird eine Röntgenuntersuchung durchgeführt, um die Lokalisation von Mirena® zu bestimmen.
Eierstockzysten
Da die empfängnisverhütende Wirkung von Mirena® hauptsächlich auf seiner lokalen Wirkung beruht, kommt es bei Frauen im fruchtbaren Alter in der Regel zu Ovulationszyklen mit Follikelruptur. Manchmal verzögert sich die Follikelatresie und die Follikelentwicklung kann fortgesetzt werden. Solche vergrößerten Follikel sind klinisch nicht von Ovarialzysten zu unterscheiden. Bei etwa 7 % der Frauen, die Mirena® einnahmen, wurden Eierstockzysten als Nebenwirkung gemeldet. In den meisten Fällen verursachen diese Follikel keine Symptome, manchmal gehen sie jedoch mit Schmerzen im Unterbauch oder beim Geschlechtsverkehr einher. In der Regel verschwinden Eierstockzysten innerhalb von zwei bis drei Monaten nach der Beobachtung von selbst. Sollte dies nicht der Fall sein, empfiehlt es sich, die Überwachung mittels Ultraschall sowie therapeutische und diagnostische Maßnahmen fortzusetzen. In seltenen Fällen ist ein chirurgischer Eingriff erforderlich.
In Mirena® enthaltene Hilfsstoffe
Die T-förmige Basis von Mirena® enthält Bariumsulfat, das bei der Röntgenuntersuchung sichtbar wird.
Es ist zu beachten, dass Mirena® nicht vor einer HIV-Infektion und anderen sexuell übertragbaren Krankheiten schützt.
Auswirkungen auf die Fähigkeit, Fahrzeuge zu fahren und Maschinen zu bedienen
Nicht beobachtet
Kontraindikationen
Schwangerschaft oder Verdacht darauf;
Entzündliche Erkrankungen der Beckenorgane (auch wiederkehrend);
Infektionen des unteren Urogenitaltrakts;
Postpartale Endometritis;
Septischer Abort innerhalb der letzten 3 Monate;
Zervizitis;
Erkrankungen, die mit einer erhöhten Anfälligkeit für Infektionen einhergehen;
Zervikale Dysplasie;
Bösartige Neubildungen der Gebärmutter oder des Gebärmutterhalses;
Gestagenabhängige Tumoren, inkl. Brustkrebs;
Pathologische Uterusblutung unbekannter Ätiologie;
Angeborene und erworbene Anomalien der Gebärmutter, inkl. Myome, die zu einer Verformung der Gebärmutterhöhle führen;
Akute Lebererkrankungen, Lebertumoren;
Alter über 65 Jahre (bei dieser Patientenkategorie wurden keine Studien durchgeführt);
Überempfindlichkeit gegen die Bestandteile des Arzneimittels.
Gelbsucht;
Diabetes mellitus
Mit Vorsicht (Vorsichtsmaßnahmen)
Das Medikament sollte mit Vorsicht und nur nach Rücksprache mit einem Spezialisten für die unten aufgeführten Erkrankungen angewendet werden. Die Zweckmäßigkeit der Entfernung des Systems sollte besprochen werden, wenn eine der folgenden Bedingungen vorliegt oder erstmals auftritt:
Migräne, fokale Migräne mit asymmetrischem Sehverlust oder anderen Symptomen, die auf eine vorübergehende zerebrale Ischämie hinweisen;
Ungewöhnlich starke Kopfschmerzen;
Gelbsucht;
Schwere arterielle Hypertonie;
Schwere Durchblutungsstörungen, inkl. Schlaganfall und Myokardinfarkt;
Angeborene Herzfehler oder Herzklappenerkrankungen (aufgrund des Risikos einer septischen Endokarditis);
Diabetes mellitus
Haltbar bis
3 Jahre.
Nach Ablauf des auf der Verpackung angegebenen Verfallsdatums nicht mehr verwenden
Produktbeschreibung
Ein intrauterines therapeutisches System (IUP) mit einer Freisetzungsrate von 20 µg/24 Stunden besteht aus einem weißen oder cremefarbenen Hormon-Elastomer-Kern, der auf einem T-förmigen Körper platziert und mit einer undurchsichtigen Membran bedeckt ist, die die Freisetzung von Levonorgestrel reguliert. Der T-förmige Körper hat an einem Ende eine Schlaufe und am anderen Ende zwei Arme; An der Schlaufe werden Fäden befestigt, um das System zu entfernen. Das IUP wird in einem Führungsrohr platziert. Das System und der Leiter sind frei von sichtbaren Verunreinigungen
Pharmakologische Wirkung
Das Medikament Mirena® ist ein intrauterines therapeutisches System (IUP), das Levonorgestrel freisetzt und überwiegend lokal gestagen wirkt. Progestin (Levonorgestrel) wird direkt in die Gebärmutterhöhle abgegeben, was eine Anwendung in einer äußerst geringen Tagesdosis ermöglicht. Hohe Konzentrationen von Levonorgestrel im Endometrium tragen dazu bei, die Empfindlichkeit seiner Östrogen- und Progesteronrezeptoren zu verringern, wodurch das Endometrium resistent gegen Östradiol wird und eine starke antiproliferative Wirkung hat. Bei der Anwendung des Medikaments Mirena® werden morphologische Veränderungen im Endometrium und eine schwache lokale Reaktion auf das Vorhandensein eines Fremdkörpers in der Gebärmutter beobachtet. Eine Erhöhung der Viskosität des Zervixsekrets verhindert das Eindringen von Spermien in die Gebärmutter. Das Medikament Mirena® verhindert die Befruchtung durch Hemmung der Spermienmotilität und -funktion in der Gebärmutter und den Eileitern. Bei manchen Frauen wird auch der Eisprung unterdrückt.
Die vorherige Anwendung von Mirena® hat keinen Einfluss auf die Fortpflanzungsfunktion. Etwa 80 % der Frauen mit Kinderwunsch werden innerhalb von 12 Monaten nach Entfernung des IUP schwanger.
In den ersten Monaten der Anwendung von Mirena® kann es aufgrund der Hemmung der Endometriumproliferation zu einer anfänglichen Zunahme von Schmierblutungen und Schmierblutungen aus der Vagina kommen. Anschließend führt eine ausgeprägte Unterdrückung der Endometriumproliferation zu einer Verringerung der Dauer und des Volumens der Menstruationsblutung bei Frauen, die Mirena® anwenden. Leichte Blutungen gehen häufig in Oligo- oder Amenorrhoe über. Gleichzeitig bleiben die Eierstockfunktion und die Östradiolkonzentration im Blutplasma normal.
Mirena® kann zur Behandlung der idiopathischen Menorrhagie, d.h. Menorrhagie ohne hyperplastische Prozesse im Endometrium (Endometriumkrebs, metastatische Läsionen der Gebärmutter, submuköse oder große interstitielle Knoten von Uterusmyomen, die zu einer Verformung der Gebärmutterhöhle führen, Adenomyose), Endometritis, extragenitale Erkrankungen und Zustände, die mit schwerer Hypokoagulation einhergehen ( zum Beispiel von-Willebrand-Krankheit, schwere Thrombozytopenie), deren Symptome Menorrhagie sind.
Nach 3-monatiger Anwendung von Mirena® verringert sich der Menstruationsblutverlust bei Frauen mit Menorrhagie um 62–94 % und nach 6-monatiger Anwendung um 71–95 %. Bei einer 2-jährigen Anwendung von Mirena® ist die Wirksamkeit des Arzneimittels (Reduktion des Menstruationsblutverlusts) mit chirurgischen Behandlungsmethoden (Ablation oder Resektion des Endometriums) vergleichbar. Ein weniger günstiges Ansprechen auf die Behandlung ist bei Menorrhagie möglich, die durch submuköse Uterusmyome verursacht wird. Durch die Verringerung des Menstruationsblutverlusts verringert sich das Risiko einer Eisenmangelanämie. Mirena® reduziert die Schwere der Dysmenorrhoe-Symptome.
Die Wirksamkeit von Mirena® bei der Vorbeugung einer Endometriumhyperplasie während einer chronischen Östrogentherapie war sowohl bei oraler als auch bei transdermaler Östrogenverabreichung gleichermaßen hoch
Pharmakokinetik
Saugen
Nach der Verabreichung des Arzneimittels Mirena® beginnt Levonorgestrel sofort in die Gebärmutterhöhle freigesetzt zu werden, was durch Messungen seiner Konzentration im Blutplasma nachgewiesen wird. Die hohe lokale Exposition des Arzneimittels in der Gebärmutterhöhle, die für die lokale Wirkung von Mirena® auf das Endometrium notwendig ist, sorgt für einen hohen Konzentrationsgradienten in Richtung vom Endometrium zum Myometrium (die Konzentration von Levonorgestrel im Endometrium übersteigt seine Konzentration in des Myometriums um mehr als das 100-fache) und niedrige Konzentrationen von Levonorgestrel im Plasmablut (die Konzentration von Levonorgestrel im Endometrium übersteigt die Konzentration im Blutplasma um mehr als das 1000-fache). Die Freisetzungsrate von Levonorgestrel in die Gebärmutterhöhle beträgt in vivo zunächst etwa 20 µg/Tag und sinkt nach 5 Jahren auf 10 µg/Tag.
Nach der Verabreichung von Mirena® wird Levonorgestrel im Blutplasma nach 1 Stunde nachgewiesen. Cmax wird 2 Wochen nach der Verabreichung von Mirena® erreicht. Im Einklang mit der sinkenden Freisetzungsrate sinkt die mittlere Plasmakonzentration von Levonorgestrel bei Frauen im gebärfähigen Alter mit einem Körpergewicht über 55 kg von 206 pg/ml (25.–75. Perzentil: 151 pg/ml–264 pg/ml), ermittelt nach 6 Monaten , bis zu 194 pg/ml (146 pg/ml-266 pg/ml) nach 12 Monaten und bis zu 131 pg/ml (113 pg/ml-161 pg/ml) nach 60 Monaten.
Verteilung
Levonorgestrel bindet unspezifisch an Serumalbumin und spezifisch an Sexualhormon-bindendes Globulin (SHBG). Etwa 1–2 % des zirkulierenden Levonorgestrel liegen als freies Steroid vor, während 42–62 % spezifisch an SHBG gebunden sind. Während der Anwendung des Arzneimittels Mirena® nimmt die Konzentration von SHBG ab. Dementsprechend nimmt der mit SHBG assoziierte Anteil während der Nutzungsdauer von Mirena® ab und der freie Anteil zu. Der durchschnittliche scheinbare Vd von Levonorgestrel beträgt etwa 106 l.
Die Pharmakokinetik von Levonorgestrel hängt von der SHBG-Konzentration ab, die wiederum durch Östrogene und Androgene beeinflusst wird. Bei der Anwendung des Arzneimittels Mirena® wurde eine Abnahme der durchschnittlichen SHBG-Konzentration um etwa 30 % beobachtet, was mit einer Abnahme der Levonorgestrel-Konzentration im Blutplasma einherging. Dies weist auf die Nichtlinearität der Pharmakokinetik von Levonorgestrel im Zeitverlauf hin. Aufgrund der vorwiegend lokalen Wirkung von Mirena® ist eine Auswirkung von Veränderungen der systemischen Konzentrationen von Levonorgestrel auf die Wirksamkeit von Mirena® unwahrscheinlich.
Es wurde gezeigt, dass das Körpergewicht und die SHBG-Plasmakonzentrationen die systemischen Levonorgestrel-Konzentrationen beeinflussen. diese. Bei geringem Körpergewicht und/oder hohen SHBG-Konzentrationen sind die Levonorgestrel-Konzentrationen höher. Bei Frauen im gebärfähigen Alter mit geringem Körpergewicht (37–55 kg) ist die mittlere Konzentration von Levonorgestrel im Blutplasma etwa 1,5-mal höher.
Bei postmenopausalen Frauen, die Mirena® gleichzeitig mit der intravaginalen oder transdermalen Anwendung von Östrogenen anwenden, sinkt die mittlere Konzentration von Levonorgestrel im Blutplasma von 257 pg/ml (25.–75. Perzentil: 186 pg/ml–326 pg/ml), bestimmt nach 12 Monate, bis zu 149 pg/ml (122 pg/ml-180 pg/ml) nach 60 Monaten. Bei gleichzeitiger Anwendung von Mirena® mit einer oralen Östrogentherapie steigt die nach 12 Monaten ermittelte Konzentration von Levonorgestrel im Blutplasma auf ca. 478 pg/ml (25.-75. Perzentil: 341 pg/ml-655 pg/ml). aufgrund der Induktion der SHBG-Synthese.
Stoffwechsel
Levonorgestrel wird weitgehend metabolisiert. Die Hauptmetaboliten im Blutplasma sind unkonjugierte und konjugierte Formen von 3α, 5β-Tetrahydrolevonorgestrel. Basierend auf den Ergebnissen von In-vitro- und In-vivo-Studien ist CYP3A4 das wichtigste Isoenzym, das am Metabolismus von Levonorgestrel beteiligt ist. Die Isoenzyme CYP2E1, CYP2C19 und CYP2C9 können ebenfalls am Metabolismus von Levonorgestrel beteiligt sein, jedoch in geringerem Maße.
Entfernung
Die gesamte Plasmaclearance von Levonorgestrel beträgt etwa 1 ml/min/kg. Unverändertes Levonorgestrel wird nur in Spuren ausgeschieden. Metaboliten werden über den Darm und die Nieren mit einem Ausscheidungskoeffizienten von etwa 1,77 ausgeschieden. T1/2 in der Endphase, hauptsächlich repräsentiert durch Metaboliten, beträgt etwa einen Tag
Hinweise zur Verwendung
Empfängnisverhütung;
Idiopathische Menorrhagie;
Vorbeugung einer Endometriumhyperplasie während einer Östrogenersatztherapie
Gebrauchsanweisung und Dosierung
Mirena® wird in die Gebärmutterhöhle verabreicht. Die Wirksamkeit hält 5 Jahre an.
Die In-vivo-Freisetzungsrate von Levonorgestrel beträgt zu Studienbeginn etwa 20 µg/Tag und sinkt nach 5 Jahren auf etwa 10 µg/Tag. Die durchschnittliche Freisetzungsrate von Levonorgestrel beträgt bis zu 5 Jahre lang etwa 14 µg/Tag.
Mirena® kann bei Frauen unter einer Hormonersatztherapie in Kombination mit oralen oder transdermalen Östrogenpräparaten, die keine Gestagene enthalten, angewendet werden.
Bei korrekter Installation von Mirena®, die gemäß den Anweisungen für die medizinische Anwendung durchgeführt wird, beträgt der Pearl-Index (ein Indikator, der die Anzahl der Schwangerschaften bei 100 Frauen widerspiegelt, die im Laufe des Jahres ein Verhütungsmittel anwenden) innerhalb eines Jahres etwa 0,2 %. Die kumulative Rate, die die Anzahl der Schwangerschaften bei 100 Frauen widerspiegelt, die 5 Jahre lang Verhütungsmittel anwenden, beträgt 0,7 %.
Zur Empfängnisverhütung bei Frauen im gebärfähigen Alter sollte Mirena® innerhalb von 7 Tagen nach Beginn der Menstruation in die Gebärmutterhöhle eingeführt werden. Mirena® kann an jedem Tag des Menstruationszyklus durch ein neues IUP ersetzt werden. Eine Spirale kann auch unmittelbar nach einem Schwangerschaftsabbruch im ersten Schwangerschaftstrimester eingesetzt werden, sofern keine entzündlichen Erkrankungen der Geschlechtsorgane vorliegen.
Nach der Geburt sollte das IUP bei der Rückbildung der Gebärmutter eingesetzt werden, jedoch nicht früher als 6 Wochen nach der Geburt. Bei längerer Subinvolution ist es notwendig, eine postpartale Endometritis auszuschließen und die Entscheidung zur Einlage des Mirena®-Spirals aufzuschieben, bis die Rückbildung abgeschlossen ist. Bei Schwierigkeiten beim Einführen des IUP und/oder sehr starken Schmerzen oder Blutungen während oder nach dem Eingriff sollte umgehend eine körperliche und Ultraschalluntersuchung durchgeführt werden, um eine Perforation auszuschließen.
Zum Schutz des Endometriums während der Östrogenersatztherapie bei Frauen mit Amenorrhoe kann jederzeit Mirena® eingesetzt werden; Bei Frauen mit anhaltender Menstruation erfolgt die Installation in den letzten Tagen der Menstruationsblutung oder der Entzugsblutung.
Regeln für die Verwendung des IUP
Mirena® wird in einer sterilen Verpackung geliefert, die erst unmittelbar vor dem Einsetzen des IUP geöffnet wird. Beim Umgang mit einem geöffneten System müssen die aseptischen Regeln beachtet werden. Wenn die Sterilität der Verpackung beeinträchtigt zu sein scheint, sollte das IUP als medizinischer Abfall entsorgt werden. Auch das aus der Gebärmutter entfernte IUP sollte behandelt werden, da es Hormonrückstände enthält.
Vor dem Einsetzen von Mirena® sollte eine Frau über die Wirksamkeit, Risiken und Nebenwirkungen dieser Spirale aufgeklärt werden. Es ist notwendig, eine allgemeine und gynäkologische Untersuchung einschließlich der Untersuchung der Beckenorgane und der Brustdrüsen sowie einen Abstrich vom Gebärmutterhals durchzuführen. Schwangerschaften und sexuell übertragbare Krankheiten sollten ausgeschlossen und entzündliche Erkrankungen der Geschlechtsorgane vollständig geheilt werden. Dabei werden die Lage der Gebärmutter und die Größe ihrer Höhle bestimmt. Ist eine Darstellung der Gebärmutter erforderlich, sollte vor dem Einsetzen der Mirena®-Spirale eine Ultraschalluntersuchung der Beckenorgane durchgeführt werden. Nach einer gynäkologischen Untersuchung wird ein spezielles Instrument, das sogenannte Vaginalspekulum, in die Vagina eingeführt und der Gebärmutterhals mit einer antiseptischen Lösung behandelt. Mirena® wird dann durch einen dünnen, flexiblen Kunststoffschlauch in die Gebärmutter injiziert. Besonders wichtig ist die korrekte Positionierung von Mirena® im Uterusfundus, was eine gleichmäßige Wirkung des Gestagens auf die Gebärmutterschleimhaut gewährleistet, den Ausstoß des IUP verhindert und die Voraussetzungen für seine maximale Wirksamkeit schafft. Daher sollten Sie die Anweisungen zur Installation von Mirena® sorgfältig befolgen. Da die Technik zur Installation verschiedener IUPs in der Gebärmutter unterschiedlich ist, sollte besonderes Augenmerk auf das Üben der richtigen Technik zur Installation eines bestimmten Systems gelegt werden. Die Frau kann das Einführen des Systems spüren, es sollte ihr jedoch keine starken Schmerzen bereiten. Vor dem Einsetzen kann bei Bedarf eine örtliche Betäubung des Gebärmutterhalses durchgeführt werden.
In einigen Fällen kann es bei Patienten zu einer Stenose des Gebärmutterhalskanals kommen. Bei der Verabreichung von Mirena® an solche Patienten sollte keine übermäßige Kraft angewendet werden.
Manchmal werden nach dem Einsetzen des IUP Schmerzen, Schwindel, Schwitzen und blasse Haut festgestellt. Frauen wird empfohlen, sich nach der Einnahme von Mirena® einige Zeit auszuruhen. Wenn diese Phänomene auch nach einer halben Stunde in ruhiger Position nicht verschwinden, ist es möglich, dass das IUP nicht richtig positioniert ist. Eine gynäkologische Untersuchung muss durchgeführt werden; Bei Bedarf wird das System entfernt. Bei manchen Frauen führt die Anwendung von Mirena® zu allergischen Hautreaktionen.
Die Frau sollte 4–12 Wochen nach der Installation erneut untersucht werden, und dann einmal im Jahr oder bei klinischer Indikation auch öfter.
Durch vorsichtiges Ziehen an den mit einer Pinzette erfassten Fäden wird Mirena® entfernt. Wenn die Fäden nicht sichtbar sind und sich das System in der Gebärmutterhöhle befindet, kann es mithilfe eines Zughakens entfernt werden, um das IUP zu entfernen. Dies kann eine Erweiterung des Gebärmutterhalskanals erfordern.
Das System sollte 5 Jahre nach der Installation entfernt werden. Wenn eine Frau die gleiche Methode weiterhin anwenden möchte, kann sofort nach der Entfernung des vorherigen Systems ein neues System installiert werden.
Wenn eine weitere Empfängnisverhütung erforderlich ist, sollte bei Frauen im gebärfähigen Alter die IUP-Entfernung während der Menstruation durchgeführt werden, sofern der Menstruationszyklus aufrechterhalten wird. Wenn das System mitten im Zyklus entfernt wird und eine Frau in der Woche davor Geschlechtsverkehr hatte, besteht für sie das Risiko, schwanger zu werden, es sei denn, sofort nach der Entfernung des alten Systems wird ein neues System installiert.
Das Einsetzen und Entfernen des IUP kann mit Schmerzen und Blutungen einhergehen. Der Eingriff kann bei Patienten mit Epilepsie aufgrund einer vasovagalen Reaktion, Bradykardie oder Krampfanfällen zu Synkopen führen, insbesondere bei Patienten mit einer Prädisposition für diese Erkrankungen oder bei Patienten mit Zervixstenose.
Nach dem Entfernen von Mirena® sollte das System auf Unversehrtheit überprüft werden. Wenn es schwierig war, das IUP zu entfernen, kam es vereinzelt vor, dass der Hormon-Elastomer-Kern auf die horizontalen Arme des T-förmigen Körpers rutschte, wodurch sie im Kern verborgen wurden. Sobald die Integrität des IUP bestätigt ist, ist in dieser Situation kein zusätzlicher Eingriff erforderlich. Stopper an den horizontalen Armen verhindern normalerweise, dass sich der Kern vollständig vom T-Körper löst.
Besondere Patientengruppen
Bei Kindern und Jugendlichen ist Mirena® nur nach der Menarche indiziert.
Mirena® wurde bei Frauen über 65 Jahren nicht untersucht, daher wird die Anwendung von Mirena® für diese Patientenkategorie nicht empfohlen.
Mirena® ist kein Mittel der ersten Wahl für postmenopausale Frauen unter 65 Jahren mit schwerer Uterusatrophie.
Mirena® ist bei Frauen mit akuten Lebererkrankungen oder Tumoren kontraindiziert.
Mirena® wurde bei Patienten mit eingeschränkter Nierenfunktion nicht untersucht.
Anleitung zum Einsetzen eines IUP
Nur durch einen Arzt mit sterilen Instrumenten installiert.
Mirena® wird mit dem Führungsdraht in einer sterilen Verpackung geliefert, die vor der Installation nicht geöffnet werden darf.
Sollte nicht erneut sterilisiert werden. Das IUP ist nur für den einmaligen Gebrauch bestimmt. Verwenden Sie Mirena® nicht, wenn die Innenverpackung beschädigt oder geöffnet ist. Sie sollten Mirena® nicht installieren, nachdem der auf der Verpackung angegebene Monat und das Jahr abgelaufen sind.
Vor der Installation sollten Sie die Informationen zur Verwendung von Mirena® lesen.
Vorbereitung auf die Einführung
1. Führen Sie eine gynäkologische Untersuchung durch, um die Größe und Lage der Gebärmutter festzustellen und Anzeichen einer akuten Genitalinfektion, einer Schwangerschaft oder anderer gynäkologischer Kontraindikationen für die Installation von Mirena® auszuschließen.
2. Der Gebärmutterhals sollte mit einem Spekulum sichtbar gemacht werden und der Gebärmutterhals und die Vagina sollten vollständig mit einer geeigneten antiseptischen Lösung gereinigt werden.
3. Bei Bedarf sollten Sie die Hilfe einer Hilfsperson in Anspruch nehmen.
4. Sie sollten die vordere Lippe des Gebärmutterhalses mit einer Pinzette fassen. Begradigen Sie den Gebärmutterhalskanal durch sanften Zug mit einer Pinzette. Die Pinzette sollte sich während der gesamten Verabreichung von Mirena® in dieser Position befinden, um einen sanften Zug des Gebärmutterhalses in Richtung des eingeführten Instruments zu gewährleisten.
5. Bewegen Sie die Uterussonde vorsichtig durch die Höhle zum Uterusfundus. Sie sollten die Richtung des Gebärmutterhalskanals und die Tiefe der Gebärmutterhöhle (den Abstand vom äußeren Muttermund zum Uterusfundus) bestimmen und Septen ausschließen in der Gebärmutterhöhle, Synechien und submukösem Fibrom. Sollte der Zervikalkanal zu eng sein, empfiehlt sich eine Kanalerweiterung und ggf. der Einsatz von Schmerzmitteln/parazervikalen Blockaden.
Einführung
1. Öffnen Sie die sterile Verpackung. Danach sollten alle Manipulationen mit sterilen Instrumenten und sterilen Handschuhen durchgeführt werden.
2. Bewegen Sie den Schieber in Pfeilrichtung nach vorne bis zur äußersten Position, um das IUP in das Führungsrohr zu ziehen.
Der Schieberegler sollte nicht nach unten bewegt werden, weil Dies kann zu einer vorzeitigen Freisetzung von Mirena® führen. In diesem Fall kann das System nicht wieder im Leiter platziert werden.
3. Halten Sie den Schieber in der äußersten Position und stellen Sie die Oberkante des Indexrings entsprechend dem von der Sonde gemessenen Abstand vom äußeren Rachenraum zum Fundus der Gebärmutter ein.
4. Während Sie den Schieber weiterhin in seiner äußersten Position halten, sollte der Führungsdraht vorsichtig durch den Gebärmutterhalskanal in die Gebärmutter vorgeschoben werden, bis der Indexring etwa 1,5 bis 2 cm vom Gebärmutterhals entfernt ist.
Der Leiter darf nicht mit Gewalt nach vorne gedrückt werden. Bei Bedarf sollte der Gebärmutterhalskanal erweitert werden.
5. Halten Sie die Führung ruhig und bewegen Sie den Schieber zur Markierung, um die horizontalen Schultern des Mirena®-Medikaments zu öffnen. Sie sollten 5-10 Sekunden warten, bis die horizontalen Schultern vollständig geöffnet sind.
6. Schieben Sie den Führungsdraht vorsichtig nach innen, bis der Indexring den Gebärmutterhals berührt. Mirena® sollte sich nun in der Grundposition befinden.
7. Während Sie die Führung in derselben Position halten, lösen Sie Mirena®, indem Sie den Schieber so weit wie möglich bewegen. Halten Sie den Schieber in der gleichen Position und entfernen Sie vorsichtig den Leiter, indem Sie daran ziehen. Schneiden Sie die Fäden so ab, dass ihre Länge 2-3 cm vom äußeren Muttermund der Gebärmutter entfernt ist.
Bestehen seitens des Arztes Zweifel an der korrekten Installation des Systems, sollte die Position des Mirena®-Arzneimittels z. B. mittels Ultraschall überprüft werden oder ggf. das System entfernt und ein neues, steriles System eingesetzt werden. Das System sollte entfernt werden, wenn es nicht vollständig in der Gebärmutterhöhle liegt. Das entfernte System sollte nicht wiederverwendet werden.
Entfernen/Ersetzen von Mirena®
Bevor Sie Mirena® entfernen/austauschen, sollten Sie die Gebrauchsanweisung von Mirena® lesen.
Durch vorsichtiges Ziehen an den mit einer Pinzette erfassten Fäden wird Mirena® entfernt.
Der Arzt kann sofort nach der Entfernung des alten ein neues Mirena®-System installieren
| Gebrauchsanweisung | Vaginal |
| Menge pro Paket | 1 Stück |
| Minimal zulässige Lagertemperatur, °C | 15 °C |
| Haltbar bis | 36 Monate |
| Maximal zulässige Lagertemperatur, °C | 30°C |
| Lagerbedingungen | Von Kindern fernhalten |
| Verfahren verlassen | Auf Rezept |
| Wirkstoff | Levonorgestrel |
| Anwendungsbereich | Urologie |
| Pharmakologische Gruppe | G02BA03 Intrauterinpessare aus Kunststoff Empfängnisverhütung mit Gestagenen |
Gebrauchsanweisung
Wirkstoffe
Verbindung
1 Intrauterinpessar enthält: Levonorgestrel 52 mg. Hilfsstoff: Polydimstilsiloxanelastomer 52 mg.
Pharmakologische Wirkung
Mirena ist ein intrauterines Kontrazeptivum. Es handelt sich um ein T-förmiges Elastomersystem (Gerät), dessen vertikaler Stab aus einem Levonorgestrel enthaltenden Behälter besteht, der mit einer speziellen Membran bedeckt ist, durch die kontinuierlich eine kontrollierte Diffusion von Levonorgestrel mit 20 µg/Tag (in der Anfangsphase) erfolgt Das direkte Eindringen in die Gebärmutterhöhle hat eine direkte lokale Wirkung auf die Gebärmutterschleimhaut, verhindert proliferative Veränderungen in der Gebärmutterschleimhaut und verringert dadurch ihre Implantationsfunktion. Außerdem erhöht es die Viskosität des Schleims des Gebärmutterhalskanals, was das Eindringen von Spermien in die Gebärmutterhöhle verhindert. Levonorgestrel hat auch eine leichte systemische Wirkung, die sich in einer Hemmung des Eisprungs in einer bestimmten Anzahl von Zyklen äußert. Mirena reduziert das Ausmaß der Menstruationsblutung und lindert prä- und menstruelle Schmerzen. Bei Frauen mit Menorrhagie verringert sich die Menge der Menstruationsblutung nach 2-3-monatiger Anwendung von Mirena um 88 %. Die Verringerung des Menstruationsblutverlusts verringert das Risiko einer Eisenmangelanämie. Die Wirksamkeit von Mirena bei der Vorbeugung einer Endometriumhyperplasie während einer kontinuierlichen Östrogentherapie war sowohl bei oraler als auch bei transdermaler Anwendung von Östrogen gleich hoch.
Pharmakokinetik
Resorption: Nach der Verabreichung von Mirena beginnt Levonorgestrel sofort in die Gebärmutterhöhle freigesetzt zu werden, wie durch Messungen seiner Konzentration im Blutplasma nachgewiesen wird. Die hohe lokale Exposition des Arzneimittels in der Gebärmutterhöhle, die für die lokale Wirkung von Mirena auf das Endometrium notwendig ist, sorgt für einen hohen Konzentrationsgradienten in Richtung vom Endometrium zum Myometrium (die Konzentration von Levonorgestrel im Endometrium übersteigt seine Konzentration im Endometrium). Myometrium um mehr als das 100-fache) und niedrige Konzentrationen von Levonorgestrel im Blutplasma (die Konzentration von Levonorgestrel im Endometrium übersteigt die Konzentration im Blutplasma um mehr als das 1000-fache). Die Freisetzungsrate von Levonorgestrel in die Gebärmutterhöhle beträgt in vivo zunächst etwa 20 µg/Tag und sinkt nach 5 Jahren auf 10 µg/Tag. Nach der Verabreichung von Mirena wird Levonorgestrel nach 1 Stunde im Blutplasma nachgewiesen 2 Wochen nach der Verabreichung von Mirena erreicht. Im Einklang mit der sinkenden Freisetzungsrate sinkt die mittlere Plasmakonzentration von Levonorgestrel bei Frauen im gebärfähigen Alter mit einem Körpergewicht über 55 kg von 206 pg/ml (25.–75. Perzentil: 151 pg/ml–264 pg/ml), ermittelt nach 6 Monaten , bis zu 194 pg/ml (146 pg/ml-266 pg/ml) nach 12 Monaten und bis zu 131 pg/ml (113 pg/ml-161 pg/ml) nach 60 Monaten Verteilung: Levonorgestrel bindet unspezifisch an Serum Albumin und insbesondere mit Sexualhormon-bindendem Globulin (SHBG). Etwa 1–2 % des zirkulierenden Levonorgestrel liegen als freies Steroid vor, während 42–62 % spezifisch an SHBG gebunden sind. Während der Einnahme des Medikaments Mirena sinkt die Konzentration von SHBG. Dementsprechend nimmt der mit SHBG assoziierte Anteil während der Nutzungsdauer von Mirena ab und der freie Anteil zu. Der durchschnittliche scheinbare Vd von Levonorgestrel beträgt etwa 106 l. Die Pharmakokinetik von Levonorgestrel hängt von der SHBG-Konzentration ab, die wiederum durch Östrogene und Androgene beeinflusst wird. Bei der Anwendung des Medikaments Mirena wurde eine Abnahme der durchschnittlichen SHBG-Konzentration um etwa 30 % beobachtet, was mit einer Abnahme der Levonorgestrel-Konzentration im Blutplasma einherging. Dies weist auf die Nichtlinearität der Pharmakokinetik von Levonorgestrel im Zeitverlauf hin. Aufgrund der vorwiegend lokalen Wirkung von Mirena ist es unwahrscheinlich, dass sich Änderungen der systemischen Konzentrationen von Levonorgestrel auf die Wirksamkeit von Mirena auswirken. Das Körpergewicht und die Konzentration von SHBG im Blutplasma haben keinen Einfluss auf die systemische Konzentration von Levonorgestrel. diese. Bei geringem Körpergewicht und/oder hohen SHBG-Konzentrationen sind die Levonorgestrel-Konzentrationen höher. Bei Frauen im gebärfähigen Alter mit geringem Körpergewicht (37–55 kg) ist die mittlere Konzentration von Levonorgestrel im Blutplasma etwa 1,5-mal höher. Bei postmenopausalen Frauen, die Mirena gleichzeitig mit der intravaginalen oder transdermalen Anwendung von Östrogenen anwenden, beträgt die mittlere Konzentration von Levonorgestrel im Blutplasma sinkt mit 257 pg/ml (25.-75. Perzentil: 186 pg/ml-326 pg/ml), bestimmt nach 12 Monaten, auf 149 pg/ml (122 pg/ml-180 pg/ml) nach 60 Monate. Bei gleichzeitiger Anwendung von Mirena mit einer oralen Östrogentherapie steigt die Plasmakonzentration von Levonorgestrel, bestimmt nach 12 Monaten, auf etwa 478 pg/ml (25.–75. Perzentil: 341 pg/ml–655 pg/ml), was auf die Induktion zurückzuführen ist Synthese von SHBG. Levonorgestrel wird größtenteils metabolisiert. Die Hauptmetaboliten im Blutplasma sind unkonjugierte und konjugierte Formen von 3α, 5β-Tetrahydrolevonorgestrel. Basierend auf den Ergebnissen von In-vitro- und In-vivo-Studien ist CYP3A4 das wichtigste Isoenzym, das am Metabolismus von Levonorgestrel beteiligt ist. Die Isoenzyme CYP2E1, CYP2C19 und CYP2C9 können ebenfalls am Metabolismus von Levonorgestrel beteiligt sein, jedoch in geringerem Maße. Elimination: Die Gesamtclearance von Levonorgestrel aus dem Blutplasma beträgt etwa 1 ml/min/kg. Unverändertes Levonorgestrel wird nur in Spuren ausgeschieden. Metaboliten werden über den Darm und die Nieren mit einem Ausscheidungskoeffizienten von etwa 1,77 ausgeschieden. T1/2 in der Endphase, hauptsächlich repräsentiert durch Metaboliten, beträgt etwa einen Tag.
Hinweise
Empfängnisverhütung; idiopathische Menorrhagie; Vorbeugung von Endometriumhyperplasie während einer Östrogenersatztherapie.
Kontraindikationen
Schwangerschaft oder Verdacht darauf; entzündliche Erkrankungen der Beckenorgane; septische Aborte; Erkrankungen, die mit einer erhöhten Anfälligkeit für Gebärmutterhalskrebs einhergehen; der Gebärmutter oder des Gebärmutterhalses; Gestagen-abhängige Tumoren, inkl. Brustkrebs; pathologische Uterusblutungen unbekannter Ätiologie; angeborene und erworbene Anomalien der Gebärmutter, inkl. Myome, die zu einer Verformung der Gebärmutterhöhle führen; akute Lebererkrankungen, Lebertumoren im Alter von über 65 Jahren (Studien wurden bei dieser Kategorie von Patienten nicht durchgeführt);
Vorsichtsmaßnahmen
Das Medikament sollte mit Vorsicht und nur nach Rücksprache mit einem Spezialisten für die unten aufgeführten Erkrankungen angewendet werden. Die Zweckmäßigkeit einer Systementfernung sollte besprochen werden, wenn eine der folgenden Erkrankungen vorliegt oder zum ersten Mal auftritt: Migräne, fokale Migräne mit asymmetrischem Sehverlust oder andere Symptome, die auf eine vorübergehende zerebrale Ischämie hinweisen; Gelbsucht; schwere arterielle Hypertonie; schwere Durchblutungsstörungen, inkl. Schlaganfall und Myokardinfarkt; angeborene Herzfehler oder Herzklappenerkrankungen (aufgrund des Risikos einer septischen Endokarditis); Diabetes mellitus
Anwendung während der Schwangerschaft und Stillzeit
Mirena sollte nicht angewendet werden, wenn Sie schwanger sind oder der Verdacht besteht, schwanger zu sein. Wenn eine Frau während der Anwendung von Mirena schwanger wird, wird empfohlen, das IUP zu entfernen, weil Jedes an Ort und Stelle verbleibende Verhütungsmittel erhöht das Risiko einer spontanen Fehlgeburt und einer Frühgeburt. Auch die Entfernung von Mirena oder die Untersuchung der Gebärmutter können zu einer Fehlgeburt führen. Wenn es nicht möglich ist, das intrauterine Kontrazeptivum vorsichtig zu entfernen, sollte die Möglichkeit eines künstlichen Schwangerschaftsabbruchs in Betracht gezogen werden. Wenn eine Frau ihre Schwangerschaft fortsetzen möchte, sollte sie über die Risiken und möglichen Folgen einer Frühgeburt für das Baby aufgeklärt werden. In solchen Fällen sollte der Schwangerschaftsverlauf sorgfältig überwacht werden. Es ist notwendig, eine Eileiterschwangerschaft auszuschließen. Der Frau sollte erklärt werden, dass sie alle Symptome melden muss, die auf Schwangerschaftskomplikationen hinweisen, insbesondere Schmerzen wie Koliken im Unterbauch, begleitet von Fieber. Trotz der intrauterinen Anwendung und der lokalen Wirkung des Hormons ist dessen teratogene Wirkung (insbesondere Virilisierung) nicht auszuschließen. kann nicht völlig ausgeschlossen werden. Aufgrund der hohen empfängnisverhütenden Wirksamkeit von Mirena sind die klinischen Erfahrungen hinsichtlich der Schwangerschaftsausgänge bei der Anwendung begrenzt. Frauen sollten jedoch darauf hingewiesen werden, dass es derzeit keine Hinweise auf Geburtsschäden gibt, die durch die Anwendung von Mirena verursacht werden, wenn Levonorgestrel in der Muttermilch bis zur Entbindung andauert, ohne dass es zu einer Erhöhung des Risikos kommt Es wird davon ausgegangen, dass die Anwendung einer reinen Gestagenmethode 6 Wochen nach der Geburt keine schwerwiegenden Auswirkungen auf das Wachstum und die Entwicklung des Kindes hat. Nur gestagene Methoden haben keinen Einfluss auf die Menge und Qualität der Muttermilch. Bei Frauen, die Mirena während der Stillzeit einnahmen, wurde über seltene Fälle von Uterusblutungen berichtet.
Gebrauchsanweisung und Dosierung
Mirena wird in die Gebärmutterhöhle eingeführt und bleibt fünf Jahre lang wirksam. Die In-vivo-Freisetzungsrate von Isvonorgesgrel beträgt anfänglich etwa 20 µg pro Tag und sinkt nach fünf Jahren auf etwa 11 µg pro Tag. Die durchschnittliche Freisetzungsrate von Levonorgestrel beträgt bis zu fünf Jahre lang etwa 14 µg pro Tag. Mirena kann bei Frauen, die eine Hormonersatztherapie erhalten, in Kombination mit oralen oder transdermalen Östrogenpräparaten angewendet werden, die keine Gestagene enthalten. Bei korrekter Anwendung von Mirena, die gemäß der Gebrauchsanweisung durchgeführt wird, wird der Pearl-Index (ein Indikator, der die Anzahl an Schwangerschaften bei 100 Frauen, die Verhütungsmittel anwenden, beträgt etwa 0,1 % pro Jahr. Während der Austreibung oder Perforation kann der Pearl-Index ansteigen.
Nebenwirkungen
Nebenwirkungen treten am häufigsten in den ersten Monaten nach der Einführung von Mirena in die Gebärmutter auf; Bei längerem Gebrauch verschwinden sie allmählich. Die folgenden unerwünschten Wirkungen wurden bei Frauen, die Mirena anwenden, beschrieben, ihr Zusammenhang mit der Anwendung des Arzneimittels wurde jedoch nicht in allen Fällen bestätigt. Zu den häufigen Nebenwirkungen (beobachtet bei mehr als 10 % der Frauen, die Mirena anwenden) gehören Veränderungen im Uterusblutungsmuster und gutartige Eierstockzysten werden bei allen Frauen, die Mirena anwenden, beobachtet. Die durchschnittliche Anzahl der Tage und Monate, an denen bei Frauen im gebärfähigen Alter Schmierblutungen beobachtet werden, verringert sich in den ersten 6 Monaten nach dem Einsetzen des IUP allmählich von 9 auf 4 Tage. Der Anteil der Frauen mit anhaltenden Blutungen (mehr als 8 Tage) sinkt in den ersten 3 Monaten der Anwendung von Mirena von 20 auf 3 %. In klinischen Studien wurde festgestellt, dass im ersten Jahr der Anwendung von Mirena bei 17 % der Frauen eine Amenorrhoe auftrat, die mindestens drei Monate anhielt Bei postmenopausalen Frauen werden Schmierblutungen und unregelmäßige Blutungen beobachtet. Anschließend nimmt ihre Häufigkeit ab und bei etwa 40 % der Frauen, die diese Therapie erhalten, verschwinden die Blutungen in den letzten 3 Monaten des ersten Behandlungsjahres vollständig. Blutungsstörungen treten in der Perimenopause häufiger auf als in der Postmenopause. Die Häufigkeit der Erkennung gutartiger Ovarialzysten hängt von der verwendeten Diagnosemethode ab. Klinischen Studien zufolge wurden bei 12 % der Frauen, die Mirena einnahmen, vergrößerte Follikel diagnostiziert. In den meisten Fällen verlief die Vergrößerung der Follikel asymptomatisch und verschwand innerhalb von 3 Monaten.
Wechselwirkung mit anderen Medikamenten
Die Wirksamkeit hormoneller Kontrazeptiva kann bei Einnahme von Arzneimitteln, die die Funktion von Leberenzymen verändern, insbesondere Primidon, Barbiturate, Diphenin, Carbamazepin, Rifampicin, Oxcarbazepin, verringert werden. Es wird vermutet, dass Griseofulvin auf die gleiche Weise wirkt. Die Wirkung dieser Medikamente auf die empfängnisverhütende Wirkung von Mirena wurde nicht untersucht; sie ist wahrscheinlich nicht signifikant, da Mirena hauptsächlich eine lokale Wirkung hat.
Besondere Anweisungen
Vor der Installation von Mirena sollten pathologische Prozesse in der Gebärmutterschleimhaut ausgeschlossen werden, da in den ersten Monaten der Anwendung häufig unregelmäßige Blutungen/Schmierblutungen beobachtet werden. Pathologische Prozesse im Endometrium sollten auch ausgeschlossen werden, wenn nach Beginn der Östrogenersatztherapie bei einer Frau, die Mirena, das zuvor zur Empfängnisverhütung verschrieben wurde, weiterhin anwendet, Blutungen auftreten. Geeignete diagnostische Maßnahmen müssen auch ergriffen werden, wenn während der Langzeitbehandlung unregelmäßige Blutungen auftreten. Mirena sollte bei Frauen mit angeborener oder erworbener Herzklappenerkrankung mit Vorsicht angewendet werden, wobei das Risiko einer septischen Endokarditis zu berücksichtigen ist. Bei der Installation oder Entfernung eines IUP sollten diesen Patienten zu prophylaktischen Zwecken Antibiotika verschrieben werden. Levonorgestrel kann in niedrigen Dosen die Glukosetoleranz beeinflussen und daher sollte seine Konzentration im Blutplasma bei Frauen mit Diabetes mellitus, die Mirena anwenden, regelmäßig überwacht werden. In der Regel ist keine Dosisanpassung von blutzuckersenkenden Medikamenten erforderlich. Einige Manifestationen einer Polyposis oder eines Endometriumkarzinoms können durch unregelmäßige Blutungen maskiert werden. In solchen Fällen ist eine zusätzliche Untersuchung erforderlich, um die Diagnose zu klären. Mirena ist kein Medikament der ersten Wahl für junge Frauen, die noch nie schwanger waren, oder für Frauen nach der Menopause mit schwerer Uterusatrophie das Risiko, bei postmenopausalen Frauen unter 50 Jahren an Brustkrebs zu erkranken. Aufgrund der begrenzten Daten, die während der Studie zu Mirena für die Indikation Prävention von Endometriumhyperplasie während einer Östrogenersatztherapie gewonnen wurden, kann das Brustkrebsrisiko bei der Anwendung von Mirena für diese Indikation nicht bestätigt oder widerlegt werden: Oligo- und Amenorrhoe in Bei Frauen im fruchtbaren Alter entwickelt sich die Erkrankung allmählich, in etwa 57 % bzw. 16 % der Fälle bis zum Ende des ersten Jahres der Anwendung von Mirena. Bleibt die Menstruation innerhalb von 6 Wochen nach Beginn der letzten Regelblutung aus, sollte eine Schwangerschaft ausgeschlossen werden. Wiederholte Schwangerschaftstests auf Amenorrhoe sind nicht erforderlich, es sei denn, es liegen andere Anzeichen einer Schwangerschaft vor. Wenn Mirena in Kombination mit einer kontinuierlichen Östrogenersatztherapie angewendet wird, entwickeln die meisten Frauen im Laufe des ersten Jahres allmählich eine Amenorrhoe. Entzündliche Erkrankungen des Beckens: Das Führungsrohr trägt dazu bei, Mirena beim Einführen vor Infektionen zu schützen, und das Mirena-Einführgerät wurde speziell entwickelt, um das Infektionsrisiko zu minimieren. Entzündliche Erkrankungen der Beckenorgane bei Patienten, die Spiralen verwenden, werden häufig als sexuell übertragbare Krankheiten eingestuft. Es wurde festgestellt, dass mehrere Sexualpartner ein Risikofaktor für Unterleibsinfektionen sind. Eine entzündliche Erkrankung des Beckens kann schwerwiegende Folgen haben: Sie kann die Fruchtbarkeit beeinträchtigen und das Risiko einer Eileiterschwangerschaft erhöhen. Wie bei anderen gynäkologischen oder chirurgischen Eingriffen kann es nach dem Einsetzen eines IUP zu einer schweren Infektion oder Sepsis (einschließlich einer Streptokokken-Sepsis der Gruppe A) kommen Bei wiederkehrenden Endometritis oder entzündlichen Erkrankungen der Beckenorgane sowie bei schweren oder akuten Infektionen, die über mehrere Tage therapieresistent sind, sollte Mirena entfernt werden. Wenn eine Frau anhaltende Schmerzen im Unterbauch, Schüttelfrost, Fieber, Schmerzen beim Geschlechtsverkehr (Dyspareunie), anhaltende oder starke Schmierblutungen/Blutungen aus der Vagina oder eine Veränderung in der Art des Vaginalausflusses hat, sollten Sie sofort Ihren Arzt konsultieren . Starke Schmerzen oder Fieber, die kurz nach dem Einsetzen eines IUP auftreten, können auf eine schwere Infektion hinweisen, die sofort behandelt werden muss. Auch wenn nur einzelne Symptome auf eine mögliche Infektion hinweisen, ist eine bakteriologische Untersuchung und Überwachung angezeigt: Mögliche Anzeichen einer teilweisen oder vollständigen Austreibung eines IUP sind Blutungen und Schmerzen. Kontraktionen der Gebärmuttermuskulatur während der Menstruation führen manchmal zur Verschiebung des IUP oder sogar zu dessen Ausstoß aus der Gebärmutter, was zum Aufhören der empfängnisverhütenden Wirkung führt. Eine teilweise Austreibung kann die Wirksamkeit von Mirena verringern. Da Mirena den Menstruationsblutverlust reduziert, kann ein erhöhter Blutverlust auf einen Ausstoß des IUP hinweisen. Einer Frau wird empfohlen, die Fäden beispielsweise beim Duschen mit den Fingern zu überprüfen. Wenn eine Frau Anzeichen einer Verschiebung oder eines Verlusts des IUP feststellt oder die Fäden nicht spüren kann, sollte sie Geschlechtsverkehr vermeiden oder andere Verhütungsmethoden anwenden und so schnell wie möglich einen Arzt aufsuchen. es sollte entfernt werden. Zu diesem Zeitpunkt sollte der Frau beigebracht werden, wie sie die Mirena-Fäden überprüft. Perforation oder Penetration des IUP-Körpers oder des Gebärmutterhalses kommt selten vor und kann die Wirksamkeit beeinträchtigen Mirena. In diesen Fällen sollte das System entfernt werden. Wenn sich die Diagnose einer Perforation und IUP-Migration verzögert, kann es zu Komplikationen wie Verwachsungen, Peritonitis, Darmverschluss, Darmperforation, Abszessen oder Erosionen benachbarter innerer Organe kommen. Bei stillenden Frauen ist das Risiko einer Gebärmutterperforation erhöht. Beim Einsetzen eines IUP nach der Geburt und bei Frauen mit fixierter Uterusflexion besteht möglicherweise ein erhöhtes Perforationsrisiko. Frauen mit einer Vorgeschichte von Eileiterschwangerschaften, Eileiteroperationen oder Beckeninfektionen haben ein höheres Risiko für eine Eileiterschwangerschaft. Die Möglichkeit einer Eileiterschwangerschaft sollte bei Schmerzen im Unterleib in Betracht gezogen werden, insbesondere wenn diese mit dem Ausbleiben der Menstruation einhergehen oder wenn eine Frau mit Amenorrhoe zu bluten beginnt. Die Inzidenz einer Eileiterschwangerschaft bei der Anwendung von Mirena beträgt etwa 0,1 % pro Jahr. Das absolute Risiko einer Eileiterschwangerschaft ist bei Frauen, die Mirena anwenden, gering. Wenn eine Frau mit eingesetzter Mirena jedoch schwanger wird, ist die relative Wahrscheinlichkeit einer Eileiterschwangerschaft höher: Wenn bei einer gynäkologischen Untersuchung die Fäden zur IUP-Entfernung im Gebärmutterhals nicht nachgewiesen werden können, muss eine Schwangerschaft ausgeschlossen werden. Die Fäden können in die Gebärmutterhöhle oder den Gebärmutterhalskanal eingezogen werden und werden nach der nächsten Menstruation wieder sichtbar. Ist eine Schwangerschaft ausgeschlossen, lässt sich die Lage der Fäden in der Regel durch sorgfältige Sondierung mit einem geeigneten Instrument bestimmen. Wenn die Fäden nicht erkannt werden können, ist es möglich, dass das IUP aus der Gebärmutterhöhle ausgestoßen wurde. Um die korrekte Platzierung des Systems zu bestimmen, kann eine Ultraschalluntersuchung durchgeführt werden. Wenn dies nicht möglich oder erfolglos ist, wird eine Röntgenuntersuchung durchgeführt, um die Lokalisation von Mirena-Zysten zu bestimmen: Da die empfängnisverhütende Wirkung von Mirena hauptsächlich auf ihrer lokalen Wirkung beruht, kommt es bei Frauen im fruchtbaren Alter in der Regel zu Eisprungszyklen mit Follikelruptur . Manchmal verzögert sich die Follikelatresie und die Follikelentwicklung kann fortgesetzt werden. Solche vergrößerten Follikel sind klinisch nicht von Ovarialzysten zu unterscheiden. Bei etwa 7 % der Frauen, die Mirena einnahmen, wurden Eierstockzysten als Nebenwirkung gemeldet. In den meisten Fällen verursachen diese Follikel keine Symptome, manchmal gehen sie jedoch mit Schmerzen im Unterbauch oder beim Geschlechtsverkehr einher. In der Regel verschwinden Eierstockzysten innerhalb von zwei bis drei Monaten nach der Beobachtung von selbst. Sollte dies nicht der Fall sein, empfiehlt es sich, die Überwachung mittels Ultraschall sowie therapeutische und diagnostische Maßnahmen fortzusetzen. In seltenen Fällen ist ein chirurgischer Eingriff erforderlich. Die im Mirena-Medikament enthaltenen Hilfsstoffe enthalten Bariumsulfat, das bei der Röntgenuntersuchung sichtbar wird Das Medikament schützt nicht vor HIV-Infektionen und anderen Krankheiten sowie sexuell übertragbaren Krankheiten. Keine Auswirkungen auf die Fähigkeit, Fahrzeuge zu fahren und Maschinen zu bedienen.