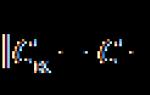Abhängigkeit des pH-Werts von der Lösungstemperatur. Abhängigkeit der Geschwindigkeit der enzymatischen Reaktion von Temperatur, pH-Wert und Inkubationszeit
PH Wert (pH-Faktor) ist ein Maß für die Aktivität von Wasserstoffionen in einer Lösung und drückt quantitativ deren Säuregehalt aus. Wenn der pH-Wert nicht optimal ist, verlieren Pflanzen allmählich die Fähigkeit, einige der Elemente aufzunehmen, die sie für ein gesundes Wachstum benötigen. Alle Pflanzen haben einen bestimmten pH-Wert, der es ihnen ermöglicht, beim Wachstum maximale Ergebnisse zu erzielen. Die meisten Pflanzen bevorzugen eine leicht saure Wachstumsumgebung (zwischen 5,5 und 6,5).
Wasserstoffindex in Formeln
In sehr verdünnten Lösungen entspricht der pH-Wert der Konzentration an Wasserstoffionen. Gleich groß und entgegengesetzt zum Dezimallogarithmus der Aktivität von Wasserstoffionen, ausgedrückt in Mol pro Liter:
pH = -lg
Unter Standardbedingungen liegt der pH-Wert zwischen 0 und 14. In reinem Wasser, bei neutralem pH-Wert, ist die Konzentration von H + gleich der Konzentration von OH – und beträgt 1·10 –7 Mol pro Liter. Der maximal mögliche pH-Wert ist als Summe aus pH und pOH definiert und beträgt 14.
Entgegen der landläufigen Meinung kann der pH-Wert nicht nur im Bereich von 0 bis 14 schwanken, sondern auch über diese Grenzen hinausgehen. Beispielsweise ist bei einer Wasserstoffionenkonzentration = 10 −15 mol/l der pH-Wert = 15, bei einer Hydroxidionenkonzentration von 10 mol/l pOH = −1.
Es ist wichtig zu verstehen! Die pH-Skala ist logarithmisch, was bedeutet, dass jede Änderungseinheit einer zehnfachen Änderung der Wasserstoffionenkonzentration entspricht. Mit anderen Worten: Eine Lösung mit einem pH-Wert von 6 ist zehnmal saurer als eine Lösung mit einem pH-Wert von 7, und eine Lösung mit einem pH-Wert von 5 ist zehnmal saurer als eine Lösung mit einem pH-Wert von 6 und hundertmal saurer als eine Lösung mit einem pH-Wert 7. Das heißt, wenn Sie den pH-Wert Ihrer Nährlösung anpassen und den pH-Wert um zwei Punkte ändern müssen (z. B. von 7,5 auf 5,5), müssen Sie zehnmal mehr pH-Einstellmittel verwenden, als wenn Sie den pH-Wert nur um ändern würden ein Punkt (von 7,5 bis 6,5).
Methoden zur Bestimmung des pH-Wertes
Zur Bestimmung des pH-Wertes von Lösungen werden häufig verschiedene Methoden eingesetzt. Der pH-Wert kann anhand von Indikatoren näherungsweise geschätzt, mit einem pH-Meter genau gemessen oder analytisch durch eine Säure-Base-Titration bestimmt werden.
Säure-Base-Indikatoren
Um die Konzentration von Wasserstoffionen grob abzuschätzen, werden häufig Säure-Base-Indikatoren verwendet – organische Farbstoffe, deren Farbe vom pH-Wert des Mediums abhängt. Zu den bekanntesten Indikatoren zählen Lackmus, Phenolphthalein, Methylorange (Methylorange) und andere. Indikatoren können in zwei unterschiedlich gefärbten Formen vorliegen – entweder sauer oder basisch. Die Farbänderung jedes Indikators erfolgt in seinem eigenen Säurebereich, normalerweise 1-2 Einheiten.
Universalindikator
 Um den Arbeitsbereich der pH-Messung zu erweitern, wird ein sogenannter Universalindikator verwendet, bei dem es sich um eine Mischung mehrerer Indikatoren handelt. Der Universalindikator ändert beim Übergang vom sauren in den basischen Bereich sukzessive seine Farbe von Rot über Gelb, Grün, Blau bis hin zu Violett.
Um den Arbeitsbereich der pH-Messung zu erweitern, wird ein sogenannter Universalindikator verwendet, bei dem es sich um eine Mischung mehrerer Indikatoren handelt. Der Universalindikator ändert beim Übergang vom sauren in den basischen Bereich sukzessive seine Farbe von Rot über Gelb, Grün, Blau bis hin zu Violett.
Lösungen solcher Mischungen – „Universalindikatoren“ – werden üblicherweise mit Streifen aus „Indikatorpapier“ imprägniert, mit deren Hilfe Sie schnell (mit einer Genauigkeit von pH-Einheiten oder sogar Zehnteln pH) den Säuregehalt der wässrigen Lösungen bestimmen können im Studium. Zur genaueren Bestimmung wird die beim Auftragen eines Lösungstropfens erhaltene Farbe des Indikatorpapiers sofort mit der Referenzfarbskala verglichen, deren Aussehen in den Bildern dargestellt ist.

Die Bestimmung des pH-Wertes mit der Indikatormethode ist bei trüben oder farbigen Lösungen schwierig.
Da die optimalen pH-Werte für Nährlösungen in der Hydrokultur einen sehr engen Bereich haben (normalerweise von 5,5 bis 6,5), verwende ich auch andere Kombinationen von Indikatoren. Unserer verfügt beispielsweise über einen Arbeitsbereich und eine Skala von 4,0 bis 8,0, was einen solchen Test im Vergleich zu Universal-Indikatorpapier genauer macht.

pH-meter
 Durch die Verwendung eines speziellen Geräts – eines pH-Meters – können Sie den pH-Wert in einem größeren Bereich und genauer (bis zu 0,01 pH-Einheiten) messen als mit Universalindikatoren. Die Methode ist praktisch und sehr genau, insbesondere nach der Kalibrierung der Indikatorelektrode im ausgewählten pH-Bereich. Es ermöglicht die Messung des pH-Werts von undurchsichtigen und farbigen Lösungen und ist daher weit verbreitet.
Durch die Verwendung eines speziellen Geräts – eines pH-Meters – können Sie den pH-Wert in einem größeren Bereich und genauer (bis zu 0,01 pH-Einheiten) messen als mit Universalindikatoren. Die Methode ist praktisch und sehr genau, insbesondere nach der Kalibrierung der Indikatorelektrode im ausgewählten pH-Bereich. Es ermöglicht die Messung des pH-Werts von undurchsichtigen und farbigen Lösungen und ist daher weit verbreitet.

Analytische volumetrische Methode
Auch die analytische volumetrische Methode – die Säure-Base-Titration – liefert genaue Ergebnisse zur Bestimmung des Säuregehalts von Lösungen. Der Testlösung wird tropfenweise eine Lösung bekannter Konzentration (Titriermittel) zugesetzt. Beim Mischen kommt es zu einer chemischen Reaktion. Der Äquivalenzpunkt – der Zeitpunkt, an dem genau genug Titriermittel vorhanden ist, um die Reaktion vollständig abzuschließen – wird mithilfe eines Indikators erfasst. Als nächstes wird der Säuregehalt der Lösung berechnet, wenn die Konzentration und das Volumen der hinzugefügten Titriermittellösung bekannt sind.
Einfluss der Temperatur auf den pH-Wert
 Der pH-Wert kann sich bei Temperaturänderungen in einem weiten Bereich ändern. Somit hat eine 0,001 molare NaOH-Lösung bei 20 °C einen pH-Wert von 11,73 und bei 30 °C einen pH-Wert von 10,83. Der Einfluss der Temperatur auf den pH-Wert wird durch unterschiedliche Dissoziation von Wasserstoffionen (H+) erklärt und ist kein experimenteller Fehler. Der Temperatureffekt kann durch die Elektronik des pH-Meters nicht ausgeglichen werden.
Der pH-Wert kann sich bei Temperaturänderungen in einem weiten Bereich ändern. Somit hat eine 0,001 molare NaOH-Lösung bei 20 °C einen pH-Wert von 11,73 und bei 30 °C einen pH-Wert von 10,83. Der Einfluss der Temperatur auf den pH-Wert wird durch unterschiedliche Dissoziation von Wasserstoffionen (H+) erklärt und ist kein experimenteller Fehler. Der Temperatureffekt kann durch die Elektronik des pH-Meters nicht ausgeglichen werden.
Anpassen des pH-Werts der Nährlösung
Ansäuerung der Nährlösung
Die Nährlösung muss in der Regel angesäuert werden. Die Aufnahme von Ionen durch Pflanzen führt zu einer allmählichen Alkalisierung der Lösung. Jede Lösung mit einem pH-Wert von 7 oder höher muss in den meisten Fällen auf den optimalen pH-Wert eingestellt werden. Zur Ansäuerung der Nährlösung können verschiedene Säuren verwendet werden. Am häufigsten werden Schwefel- oder Phosphorsäure verwendet. Eine bessere Lösung für Hydrokulturlösungen sind Pufferzusätze wie und. Diese Produkte bringen nicht nur den pH-Wert auf ein optimales Niveau, sondern stabilisieren ihn auch über einen langen Zeitraum.
Bei der pH-Wert-Einstellung sowohl mit Säuren als auch mit Laugen sollten Gummihandschuhe getragen werden, um Hautverbrennungen zu vermeiden. Ein erfahrener Chemiker geht gekonnt mit konzentrierter Schwefelsäure um, indem er die Säure tropfenweise ins Wasser gibt. Aber für Anfänger in der Hydrokultur ist es vielleicht besser, sich an einen erfahrenen Chemiker zu wenden und ihn zu bitten, eine 25-prozentige Schwefelsäurelösung herzustellen. Unter Zugabe von Säure wird die Lösung gerührt und ihr pH-Wert bestimmt. Sobald Sie die ungefähre Menge Schwefelsäure kennen, können Sie diese aus einem Messzylinder hinzufügen.
Schwefelsäure muss in kleinen Portionen zugegeben werden, um die Lösung nicht zu stark anzusäuern, die dann erneut alkalisiert werden muss. Für einen unerfahrenen Arbeiter kann die Versauerung und Alkalisierung unbegrenzt andauern. Eine solche Regelung verschwendet nicht nur Zeit und Reagenzien, sondern bringt auch die Nährlösung aufgrund der Ansammlung von für Pflanzen unnötigen Ionen aus dem Gleichgewicht.
Alkalisierung der Nährlösung
Zu saure Lösungen werden mit Natriumhydroxid (Natriumhydroxid) alkalisch gemacht. Wie der Name schon sagt, handelt es sich um eine ätzende Substanz, daher müssen Gummihandschuhe getragen werden. Es wird empfohlen, Natriumhydroxid in Tablettenform zu kaufen. In Geschäften für Haushaltschemikalien kann Natriumhydroxid als Abflussreiniger gekauft werden, beispielsweise „Mole“. Lösen Sie eine Tablette in 0,5 Liter Wasser auf und geben Sie die alkalische Lösung nach und nach unter ständigem Rühren zur Nährlösung hinzu, wobei Sie häufig den pH-Wert überprüfen. Keine mathematischen Berechnungen können bestimmen, wie viel Säure oder Lauge in einem bestimmten Fall hinzugefügt werden sollte.
Wenn Sie mehrere Pflanzen in einer Schale anbauen möchten, müssen Sie diese so auswählen, dass nicht nur ihr optimaler pH-Wert übereinstimmt, sondern auch ihr Bedarf an anderen Wachstumsfaktoren. Gelbe Narzissen und Chrysanthemen benötigen beispielsweise einen pH-Wert von 6,8, aber unterschiedliche Luftfeuchtigkeiten, sodass sie nicht in derselben Schale gezüchtet werden können. Wenn Sie Narzissen die gleiche Menge Feuchtigkeit wie Chrysanthemen geben, verfaulen die Narzissenzwiebeln. In Experimenten erreichte Rhabarber bei pH 6,5 seine maximale Entwicklung, konnte aber auch bei pH 3,5 wachsen. Hafer, der einen pH-Wert von etwa 6 bevorzugt, liefert bei einem pH-Wert von 4 gute Erträge, wenn die Stickstoffdosis in der Nährlösung stark erhöht wird. Kartoffeln wachsen in einem ziemlich weiten pH-Bereich, am besten gedeihen sie jedoch bei einem pH-Wert von 5,5. Unterhalb dieses pH-Wertes werden auch hohe Knollenerträge erzielt, diese nehmen jedoch einen säuerlichen Geschmack an. Um möglichst hochwertige Erträge zu erzielen, muss der pH-Wert der Nährlösungen genau eingestellt werden.
Bevor die Elektroden zum ersten Mal verwendet werden, müssen sie kalibriert werden. Hierfür stehen spezielle Kalibrierlösungen zur Verfügung, die auf bestimmte pH-Werte gepuffert sind. Die Pufferung funktioniert so, dass das Eindringen einer kleinen Menge Wasser beim Eintauchen der Elektrode die Kalibrierung nicht beeinträchtigt. Bei der Kalibrierung geht es darum, den herstellungs- und gebrauchsbedingten Elektrodenfehler auf bestimmte Werte einzustellen. Dabei sind zwei Fehler zu berücksichtigen: die Abweichung vom Nullpunkt und die „Steigung“ des Fehlers.
Beide Fehler führen zu einem Gesamtmessfehler. Daher müssen zwei Punkte kalibriert werden, damit beide Messfehler korrigiert werden können.
Nullpunktfehler. Die obige Abbildung zeigt die Messkurve und die Referenzkurve. In diesem Beispiel weicht die Messkurve deutlich von der Referenzkurve bei pH 7 ab, d. h. Am Neutralpunkt erkennen wir einen offensichtlichen Nullpunktfehler, der behoben werden muss. Die Elektroden werden zunächst in die Kalibrierlösung pH 7 eingetaucht. Es ist wichtig, dass mindestens die Glasmembran und das Diaphragma in die Lösung eingetaucht sind. In unserem Beispiel liegt der Messwert über dem Sollwert und weicht somit vom Nennwert ab. Das Potentiometer mit variablem Widerstand stellt den Messwert auf den richtigen Wert ein. In diesem Fall wird die gesamte Messkurve um den Nullpunktfehler parallel verschoben, sodass sie genau durch den Neutralpunkt verläuft. Damit ist das Messgerät auf den Nullpunkt eingestellt und betriebsbereit.
Um pH-Elektroden zu kalibrieren, muss zunächst ein Nullpunkt eingestellt werden
Steigungsfehler. Nach der Kalibrierung des Nullpunktes erhalten wir die in der nebenstehenden Abbildung dargestellte Situation. Der Nullpunkt wird genau bestimmt, der Messwert weist jedoch immer noch einen erheblichen Fehler auf, da der Steigungspunkt noch nicht bestimmt wurde. Nun wird eine Kalibrierlösung ausgewählt, deren pH-Wert von 7 abweicht. Meist werden Pufferlösungen im pH-Bereich von 4 bis 9 verwendet. Die Elektrode wird in eine zweite Pufferlösung getaucht und die Steigungsabweichung vom Soll-(Standard-)Wert ermittelt mit einem Potentiometer. Und erst jetzt stimmt die Messkurve mit der Sollkurve überein; Das Gerät ist kalibriert.

Wenn der Nullpunkt festgelegt ist, muss der zweite relative Wert eingestellt werden – die Steigung
Einfluss der Temperatur.Änderungen des pH-Wertes werden durch die Wassertemperatur beeinflusst. Es ist jedoch nicht klar, ob bei unseren Messgeräten eine Temperaturkompensation notwendig ist. Die nebenstehende Tabelle zeigt pH-Werte in Abhängigkeit von der Temperatur, wobei das Gerät auf 20°C kalibriert wurde. Zu beachten ist, dass sich bei den für uns interessanten Temperaturen und pH-Werten der Messfehler aufgrund von Temperaturabweichungen auf die zweite Nachkommastelle beschränkt. Daher hat ein solcher Messfehler für Aquarianer keine praktische Bedeutung und eine Temperaturkompensation ist nicht erforderlich. Neben rein messtechnischen Abweichungen aufgrund unterschiedlicher Spannungen an den Elektroden sind auch die Temperaturabweichungen kalibrierter Lösungen zu berücksichtigen, die in der nebenstehenden Tabelle aufgeführt sind.
Wir sehen hier, dass diese Abweichungen relativ gering sind und nicht mehr als ±2 % betragen.
Abweichung der gemessenen pH-Werte in Abhängigkeit von der Temperatur
| PH Wert | ||||||
| 4 | 5 | 6 | 7 | 8 | 9 | |
| 0 °C | 3,78 | 4,85 | 5,93 | 7,00 | 8,07 | 9,15 |
| 5°C | 3,84 | 4,89 | 5,95 | 7,00 | 8,05 | 9,11 |
| 10°C | 3,89 | 4,93 | 5,96 | 7,00 | 8,04 | 9,07 |
| 15 °C | 3,95 | 4,97 | 5,98 | 7,00 | 8,02 | 9,03 |
| 20°C | 4,00 | 5,00 | 6,00 | 7,00 | 8,00 | 9,00 |
| 25 °C | 4,05 | 5,03 | 6,02 | 7,00 | 7,98 | 8,97 |
| 30°C | 4,10 | 5,07 | 6,03 | 7,00 | 7,97 | 8,93 |
| 35°C | 4,15 | 5,10 | 6,05 | 7,00 | 7,95 | 8,90 |
Abhängigkeit der Temperatur von Pufferlösungen
| Temperatur °C | PH Wert | Abweichung % | PH Wert | Abweichung % | PH Wert | Abweichung % |
| 5 | 4,01 | 0,25 | 7,07 | 1,00 | 9,39 | 1,84 |
| 10 | 4,00 | 0,00 | 7,05 | 0,71 | 9,33 | 1,19 |
| 15 | 4,00 | 0,00 | 7,03 | 0,43 | 9,27 | 0,54 |
| 20 | 4,00 | 0,00 | 7,00 | 0,00 | 9,22 | 0,00 |
| 25 | 4,01 | 0,25 | 7,00 | 0,00 | 9,18 | -0,43 |
| 30 | 4,01 | 0,25 | 6,97 | -0,43 | 9,14 | -0,87 |
| 35 | 4,02 | 0,50 | 6,96 | -0,57 | 9,10 | -1,30 |
Kontrolle. Zur Kontrolle empfiehlt es sich, die Elektroden erneut in eine Pufferlösung mit pH 7 einzutauchen und zu prüfen, ob die Werte übereinstimmen. Wenn der pH-Wert der Elektrode mit dem des Messgerätes übereinstimmt, können damit Wasserproben gemessen werden. Bei persönlichen Beanstandungen der Genauigkeit muss die Kalibrierung innerhalb der vorgegebenen Frist wiederholt werden. Als Richtwert können ein bis zwei Wochen empfohlen werden. Bei der Kalibrierung von pH-Elektroden sollten Sie auch darauf achten, wie schnell sich der pH-Wert am Gerät dem pH-Wert in der Pufferlösung annähert.
PH Wert, pH-Wert(lat. POndus Hydrogenii- „Gewicht des Wasserstoffs“, ausgesprochen „peh“) ist ein Maß für die Aktivität (in stark verdünnten Lösungen äquivalent zur Konzentration) von Wasserstoffionen in einer Lösung, die quantitativ deren Säuregehalt ausdrückt. Gleich groß und entgegengesetzt im Vorzeichen des dezimalen Logarithmus der Aktivität von Wasserstoffionen, ausgedrückt in Mol pro Liter:
Verlauf des pH-Wertes.
Konzept PH Wert 1909 vom dänischen Chemiker Sørensen eingeführt. Der Indikator heißt pH-Wert (nach den Anfangsbuchstaben lateinischer Wörter Potentia Hydrogeni- die Stärke von Wasserstoff, oder Pondus Hydrogeni- Gewicht des Wasserstoffs). In der Chemie durch Kombination pX bezeichnen normalerweise eine Größe, die gleich ist log X, und der Brief H bezeichnen in diesem Fall die Konzentration von Wasserstoffionen ( H+) oder vielmehr die thermodynamische Aktivität von Hydroniumionen.
Gleichungen bezüglich pH und pOH.
pH-Wert anzeigen.
In reinem Wasser bei 25 °C beträgt die Konzentration an Wasserstoffionen ([ H+]) und Hydroxidionen ([ OH− ]) sich als identisch herausstellen und gleich 10 −7 mol/l sind, ergibt sich dies eindeutig aus der Definition des Ionenprodukts von Wasser, gleich [ H+] · [ OH− ] und beträgt 10 −14 mol²/l² (bei 25 °C).
Wenn die Konzentrationen zweier Ionenarten in einer Lösung gleich sind, spricht man von einer neutralen Reaktion der Lösung. Bei Zugabe einer Säure zu Wasser steigt die Konzentration an Wasserstoffionen und die Konzentration an Hydroxidionen nimmt ab; bei Zugabe einer Base hingegen steigt der Gehalt an Hydroxidionen und die Konzentration an Wasserstoffionen nimmt ab. Wann [ H+] > [OH− ] Es wird gesagt, dass die Lösung sauer ist, und wenn [ OH − ] > [H+] - alkalisch.
Um die Vorstellung einfacher zu machen, verwenden Sie zum Entfernen des negativen Exponenten anstelle der Konzentrationen der Wasserstoffionen deren dezimalen Logarithmus, der mit dem entgegengesetzten Vorzeichen genommen wird, nämlich dem Wasserstoffexponenten – pH-Wert.
Ein Indikator für die Basizität einer Lösung pOH.
Der umgekehrte Weg ist etwas weniger beliebt pH-Wert Wert - Basizitätsindex der Lösung, pOH, was dem dezimalen Logarithmus (negativ) der Ionenkonzentration in der Lösung entspricht OH − :
wie in jeder wässrigen Lösung bei 25 °C, das heißt bei dieser Temperatur:
pH-Werte in Lösungen unterschiedlichen Säuregehalts.
- Entgegen der landläufigen Meinung, pH-Wert kann über den Bereich von 0 bis 14 hinausgehen und auch über diese Grenzen hinausgehen. Beispielsweise bei einer Konzentration von Wasserstoffionen [ H+] = 10 −15 mol/l, pH-Wert= 15, bei einer Hydroxidionenkonzentration von 10 mol/l pOH = −1 .
Weil bei 25 °C (Standardbedingungen) [ H+] [OH − ] = 10 −14 , dann ist das bei einer solchen Temperatur klar pH + pHOH = 14.
Weil in sauren Lösungen [ H+] > 10 −7 , also für saure Lösungen pH-Wert < 7, соответственно, у щелочных растворов pH-Wert > 7 , pH-Wert neutrale Lösungen ist gleich 7. Bei höheren Temperaturen erhöht sich die elektrolytische Dissoziationskonstante von Wasser, was bedeutet, dass das Ionenprodukt von Wasser zunimmt, dann ist es neutral pH-Wert= 7 (was gleichzeitig erhöhten Konzentrationen entspricht H+, so und OH−); mit sinkender Temperatur dagegen neutral pH-Wert erhöht sich.
Methoden zur Bestimmung des pH-Wertes.
Für die Wertermittlung gibt es mehrere Methoden pH-Wert Lösungen. Der Wasserstoffindex wird mithilfe von Indikatoren näherungsweise geschätzt und mithilfe von genau gemessen pH-Wert-meter oder analytisch durch Säure-Base-Titration bestimmt.
- Für eine grobe Abschätzung der Wasserstoffionenkonzentration wird es häufig verwendet Säure-Base-Indikatoren- organische Farbstoffe, deren Farbe davon abhängt pH-Wert Umfeld. Die beliebtesten Indikatoren: Lackmus, Phenolphthalein, Methylorange (Methylorange) usw. Indikatoren können in zwei unterschiedlich gefärbten Formen vorliegen – entweder sauer oder basisch. Die Farbe aller Indikatoren ändert sich innerhalb ihres eigenen Säuregehaltsbereichs, oft um 1-2 Einheiten.
- Zur Vergrößerung des Arbeitsmessintervalls pH-Wert anwenden Universalindikator, was eine Mischung aus mehreren Indikatoren ist. Der Universalindikator ändert seine Farbe sequentiell von Rot über Gelb, Grün, Blau zu Violett, wenn er von einem sauren in einen alkalischen Bereich übergeht. Definitionen pH-Wert Die Verwendung der Indikatormethode ist bei trüben oder farbigen Lösungen schwierig.
- Verwendung eines speziellen Geräts - pH-Wert-Meter - ermöglicht das Messen pH-Wertüber einen größeren Bereich und genauer (bis zu 0,01 Einheiten). pH-Wert) als die Verwendung von Indikatoren. Ionometrische Bestimmungsmethode pH-Wert basiert auf der Messung der EMK eines galvanischen Stromkreises mit einem Millivoltmeter-Ionometer, das eine Glaselektrode enthält, deren Potenzial von der Ionenkonzentration abhängt H+ in der umgebenden Lösung. Die Methode ist äußerst genau und praktisch, insbesondere nach der Kalibrierung der Indikatorelektrode im ausgewählten Bereich pH-Wert, was eine Messung ermöglicht pH-Wert undurchsichtige und farbige Lösungen und wird daher häufig verwendet.
- Analytische volumetrische Methode — Säure-Base-Titration– liefert auch genaue Ergebnisse zur Bestimmung des Säuregehalts von Lösungen. Der zu prüfenden Lösung wird tropfenweise eine Lösung bekannter Konzentration (Titriermittel) zugesetzt. Beim Mischen kommt es zu einer chemischen Reaktion. Der Äquivalenzpunkt – der Zeitpunkt, an dem genau genug Titriermittel vorhanden ist, um die Reaktion abzuschließen – wird mithilfe eines Indikators erfasst. Wenn anschließend die Konzentration und das Volumen der zugegebenen Titriermittellösung bekannt sind, wird der Säuregehalt der Lösung bestimmt.
- pH-Wert:
0,001 mol/L HCl bei 20 °C hat pH=3, bei 30 °C pH=3,
0,001 mol/L NaOH bei 20 °C hat pH=11,73, bei 30 °C pH=10,83,
Einfluss der Temperatur auf Werte pH-Wert erklärt sich durch unterschiedliche Dissoziation von Wasserstoffionen (H+) und ist kein experimenteller Fehler. Der Temperatureinfluss kann elektronisch nicht kompensiert werden pH-Wert-Meter.
Die Rolle des pH-Werts in Chemie und Biologie.
Der Säuregehalt der Umgebung ist für die meisten chemischen Prozesse wichtig und die Möglichkeit des Auftretens oder das Ergebnis einer bestimmten Reaktion hängt oft davon ab pH-Wert Umfeld. Um einen bestimmten Wert zu erhalten pH-Wert Im Reaktionssystem, bei Laboruntersuchungen oder in der Produktion werden Pufferlösungen verwendet, die eine nahezu konstante Werthaltung ermöglichen pH-Wert wenn es verdünnt wird oder wenn der Lösung kleine Mengen Säure oder Alkali zugesetzt werden.
PH Wert pH-Wert Wird häufig zur Charakterisierung der Säure-Base-Eigenschaften verschiedener biologischer Medien verwendet.
Für biochemische Reaktionen ist der Säuregehalt des in lebenden Systemen auftretenden Reaktionsmediums von großer Bedeutung. Die Konzentration von Wasserstoffionen in einer Lösung beeinflusst häufig die physikalisch-chemischen Eigenschaften und die biologische Aktivität von Proteinen und Nukleinsäuren. Daher ist die Aufrechterhaltung der Säure-Basen-Homöostase für das normale Funktionieren des Körpers eine Aufgabe von außerordentlicher Bedeutung. Dynamische Aufrechterhaltung des Optimums pH-Wert biologische Flüssigkeiten wird unter dem Einfluss der körpereigenen Puffersysteme erreicht.
Im menschlichen Körper ist der pH-Wert in verschiedenen Organen unterschiedlich.
|
Einige Bedeutungen pH-Wert. |
|
|
Substanz |
|
|
Elektrolyt in Bleibatterien |
|
|
Magensäure |
|
|
Zitronensaft (5%ige Zitronensäurelösung) |
|
|
Speiseessig |
|
|
Coca-Cola |
|
|
Apfelsaft |
|
|
Gesunde Haut |
|
|
Saurer Regen |
|
|
Trinkwasser |
|
|
Reines Wasser bei 25 °C |
|
|
Meerwasser |
|
|
Seife (Fett) für die Hände |
|
|
Ammoniak |
|
|
Bleichmittel (Bleichmittel) |
|
|
Konzentrierte Alkalilösungen |
|
Ziele des Studiums des Themas:
- Fachergebnisse: Studium der Konzepte „elektrolytische Dissoziation“, „Grad der elektrolytischen Dissoziation“, „Elektrolyt“, Entwicklung von Kenntnissen über den Wasserstoffindex, Entwicklung von Fähigkeiten im Umgang mit Stoffen auf der Grundlage der Einhaltung von Sicherheitsvorschriften;
- Metafach-Ergebnisse: Entwicklung von Fähigkeiten zur Durchführung von Experimenten mit digitalen Geräten (Gewinnung experimenteller Daten), Verarbeitung und Präsentation der erzielten Ergebnisse;
- Persönliche Ergebnisse: Entwicklung von Fähigkeiten zur Durchführung pädagogischer Forschung auf der Grundlage eines Laborexperiments.
Die Machbarkeit der Nutzung des Projekts „pH und Temperatur“.
1. Die Arbeit an dem Projekt trägt dazu bei, Interesse am Studium des theoretischen Themas „Theorie der elektrolytischen Dissoziation“ zu wecken, das für dieses Alter (13-14 Jahre) schwierig ist. In diesem Fall stellen die Schüler bei der Bestimmung des pH-Werts den Zusammenhang zwischen dem Grad der Säuredissoziation und der Temperatur der Lösung her. Die Arbeit mit einer Sodalösung hat in der 8. Klasse propädeutischen Charakter und ermöglicht die Rückkehr zu den Ergebnissen des Projekts in der 9. Klasse (außerschulische Aktivitäten), 11. Klasse (allgemeiner Kurs) beim Studium der Hydrolyse von Salzen.
2. Verfügbarkeit von Reagenzien (Zitronensäure, Backpulver) und Ausrüstung (falls keine digitalen pH-Sensoren vorhanden sind, können Sie Indikatorpapier verwenden) für die Forschung.
3. Die Zuverlässigkeit der experimentellen Methodik gewährleistet einen reibungslosen Arbeitsablauf und ist vor Störungen und methodischen Ausfällen geschützt.
4. Sicherheit des Experiments.
Instrumentalteil
Ausrüstung:
1) digitaler pH-Sensor oder Labor-pH-Meter, Lackmuspapier oder andere Säureindikatoren;
2) Alkoholthermometer (von 0 bis 50 °C) oder digitaler Temperatursensor;
3) Zitronensäure (1 Teelöffel);
4) Backpulver (1 Teelöffel);
5) destilliertes Wasser (300 ml);
6) ein Behälter für ein Wasserbad (Aluminium- oder Emaillepfanne oder -schüssel), Lösungen können mit einem kalten Wasser- oder Schneestrahl gekühlt und mit heißem Wasser erhitzt werden;
7) Becher mit Schliffdeckel mit einem Fassungsvermögen von 50-100 ml (3 Stk.).
Lektion Nr. 1. Formulierung des Problems
Unterrichtsplan:
1. Diskussion der Begriffe „elektrolytische Dissoziation“, „Grad der elektrolytischen Dissoziation“, „Elektrolyt“.
2. Darstellung des Problems. Planung eines instrumentellen Experiments.
Inhalte der Aktivität
Lehreraktivitäten
1. Organisiert eine Diskussion der Konzepte „elektrolytische Dissoziation“, „Grad der elektrolytischen Dissoziation“, „Elektrolyt“. Fragen:
- Welche Arten von Elektrolyten gibt es?
- Wie hoch ist der Grad der elektrolytischen Dissoziation?
- Wie schreibt man die Dissoziationsgleichung für starke (am Beispiel Schwefelsäure, Aluminiumsulfat) und schwache Elektrolyte (am Beispiel Essigsäure)?
- Wie beeinflusst die Konzentration der Lösung den Dissoziationsgrad?
Die Antwort lässt sich am Beispiel verdünnter und konzentrierter Lösungen von Essigsäure diskutieren. Wenn es möglich ist, die elektrische Leitfähigkeit zu bestimmen, ist es möglich, die unterschiedliche elektrische Leitfähigkeit von Essigessenz und Tafelessig nachzuweisen
Nehmen Sie neue Informationen zum Thema wahr. Entwicklung von Vorstellungen über den Grad der Dissoziation, die im Chemieunterricht gebildet wurden. Kognitiv
Bewerten Sie die Vollständigkeit des Verständnisses des Themas. Fähigkeit, das Verständnis des Problems zu analysieren
Lehreraktivitäten
2. Organisiert die Planung und Vorbereitung des instrumentellen Experiments:
- Kennenlernen der Informationen aus dem Projekt „pH-Wert und Temperatur“;
- Diskussion des Projektziels, Hypothese;
- Organisation von Arbeitsgruppen (drei Gruppen);
- Vorbereitung der Ausrüstung
Durchgeführte Aktionen Gebildete Aktivitätsmethoden Schüleraktivitäten
Informationen zu Sicherheitsregeln beim Umgang mit Säuren (Zitronensäure) wahrnehmen. Entwicklung des Konzepts zur Notwendigkeit der Einhaltung von Sicherheitsregeln. Kognitiv
Klären Sie Unklarheiten. Fähigkeit, eine Frage zu einem Thema zu formulieren. Kommunikativ
Bewerten Sie die Vollständigkeit des Verständnisses der Methodik für die Arbeit am Projekt. Fähigkeit, das Verständnis des regulatorischen Problems zu analysieren
Lektion Nr. 2. Durchführung eines Experiments
Unterrichtsplan:
1. Vorbereitung für den Betrieb digitaler pH- und Temperatursensoren.
2. Durchführung einer Untersuchung der Abhängigkeit des pH-Werts von der Temperatur:
Gruppe 1: Messung des pH-Werts einer Zitronensäurelösung bei 10 0C, 25 0C, 40 0C;
Gruppe 2: Messung des pH-Werts einer Backpulverlösung bei 10 0C, 25 0C, 40 0C;
Gruppe 3: Messung des pH-Werts von destilliertem Wasser bei 10 0C, 25 0C, 40 0C.
3. Primäranalyse der erzielten Ergebnisse. Ausfüllen der GlobalLab-Projektfragebögen.
Lehreraktivitäten
1. Organisiert Arbeitsplätze für jede Studentengruppe:
- erklärt, wie man Lösungen abkühlt, sie dann allmählich erhitzt und Temperatur- und pH-Werte misst;
- beantwortet Fragen der Schüler
Durchgeführte Aktionen Gebildete Aktivitätsmethoden Schüleraktivitäten
Informationen basierend auf Betriebsmethoden wahrnehmen. Entwicklung von Ideen zur Funktionsweise digitaler Sensoren. Kognitiv
Klären Sie Unklarheiten. Fähigkeit, eine Frage zu einem Thema zu formulieren. Kommunikativ
Bewerten Sie die Vollständigkeit des Verständnisses der Arbeit am Projekt. Fähigkeit, das Verständnis des regulatorischen Problems zu analysieren
Lehreraktivitäten
2. Organisiert die Arbeit der Studierenden in Gruppen. Der Lehrer überwacht den Fortschritt der Gruppenarbeit, beantwortet mögliche Fragen der Schüler und überwacht die Vervollständigung der Tabelle mit den Forschungsergebnissen an der Tafel
Durchgeführte Aktionen Gebildete Aktivitätsmethoden Schüleraktivitäten
1. Digitale Sensoren an den PC anschließen.
2. Lösungen vorbereiten:
1. Gruppe - Zitronensäure;
2. Gruppe – Backpulver;
3. Gruppe – destilliertes Wasser.
3. Kühlen Sie die Lösungen ab und messen Sie den pH-Wert bei 10 0C.
4. Die Lösungen werden nach und nach erhitzt und der pH-Wert bei 25 0C und 40 0C gemessen.
5. Die Messergebnisse werden in eine allgemeine Tabelle eingetragen, die an die Tafel gezeichnet wird (praktisch zur Diskussion). Ausbildung von Fähigkeiten zur Durchführung instrumenteller Forschung. Kognitiv
Arbeit in Gruppen. Pädagogische Zusammenarbeit in Gruppen. Kommunikativ
Sie arbeiten an einem gemeinsamen Problem und beurteilen dabei das Tempo und die Vollständigkeit der geleisteten Arbeit. Die Fähigkeit, ihre Handlungen zu analysieren und sie auf der Grundlage der gemeinsamen Arbeit der gesamten Klasse zu korrigieren
Lehreraktivitäten
3. Organisiert die primäre Analyse der Forschungsergebnisse. Organisiert die Arbeit der Studierenden zum Ausfüllen von Fragebögen für das GlobalLab-Projekt „pH und Temperatur“
Durchgeführte Aktionen Gebildete Aktivitätsmethoden Schüleraktivitäten
Machen Sie sich mit den Ergebnissen der Arbeit anderer Gruppen vertraut. Bildung von Ideen über die Abhängigkeit des pH-Werts von der Temperatur. Kognitiv
Stellen Sie Fragen an Vertreter anderer Gruppen. Pädagogische Zusammenarbeit mit Klassenkameraden. Entwicklung der kommunikativen mündlichen Rede
Analysieren Sie die Ergebnisse ihrer Arbeit, füllen Sie den Projektfragebogen aus. Fähigkeit, ihre Handlungen zu analysieren und die Ergebnisse ihrer Arbeit regulatorisch zu präsentieren
Lektion Nr. 3. Analyse und Präsentation der erzielten Ergebnisse
Inhalte der Aktivität
1. Ergebnispräsentation: Schülerleistungen.
2. Diskussion von Schlussfolgerungen, die für Teilnehmer an Projekten mit digitalen pH-Sensoren von Bedeutung sind.
Lehreraktivitäten
1. Organisiert Schüleraufführungen. Unterstützt Lautsprecher. Zieht ein Fazit zur Arbeit am Projekt und dankt allen Teilnehmern
Durchgeführte Aktionen Gebildete Aktivitätsmethoden Schüleraktivitäten
Präsentieren Sie die Ergebnisse Ihrer Aktivitäten, hören Sie sich die Reden Ihrer Klassenkameraden an. Bildung von Ideen über die Form der Präsentation der Ergebnisse des Projekts Kognitiv
Beteiligen Sie sich an der Diskussion von Reden. Pädagogische Zusammenarbeit mit Klassenkameraden. Entwicklung der kommunikativen mündlichen Rede
Analysieren Sie die Ergebnisse ihrer Arbeit, kommentieren Sie die Aussagen von Klassenkameraden. Fähigkeit, die Ergebnisse ihrer Aktivitäten und die Arbeit anderer Personen zu analysieren
Lehreraktivitäten
2. Organisiert eine Diskussion der im Projekt gestellten Frage „Wie verhält sich der pH-Wert einer Lösung, wenn sie gekühlt oder erhitzt wird?“ Warum versuchen Wissenschaftler, den pH-Wert bei gleicher Temperatur zu messen und welche Schlussfolgerung sollten die GlobalLab-Projektteilnehmer daraus ziehen?“
Organisiert eine Diskussion der Ergebnisse zur Bestätigung oder Widerlegung der Projekthypothese „Ändert sich die Temperatur von Lösungen, ändert sich die Dissoziationskonstante gelöster Säuren und Laugen und damit auch der pH-Wert“
Durchgeführte Aktionen Gebildete Aktivitätsmethoden Schüleraktivitäten
Besprechen Sie die Beziehung zwischen dem pH-Wert der Lösung und der Temperatur. Entwicklung von Vorstellungen über den Grad der elektrolytischen Dissoziation. Kognitiv
Bringen Sie Ihre Gedanken zur Projekthypothese zum Ausdruck und formulieren Sie eine Schlussfolgerung. Lernzusammenarbeit mit Klassenkameraden. Entwicklung der kommunikativen mündlichen Rede
Bewerten Sie die Projekthypothese auf der Grundlage der erzielten Ergebnisse. Fähigkeit, die Hypothese auf der Grundlage der bereits erzielten Ergebnisse zu bewerten und eine regulatorische Schlussfolgerung zu formulieren
Die Artikel in diesem Abschnitt können im Word-Format (Text und Bilder) und im Excel-Format (Text, Bilder, Arbeitsfragmente von Berechnungen) heruntergeladen werden.
Wenn Ihnen die in der vorherigen Lektion besprochenen Bilder jedoch immer noch nicht gefallen, können Sie kurze Programme anbieten, die im Bereich NaCl = 0–500 μg/kg und t = 10–50 °C mit einem Extrapolationsfehler arbeiten von bis zu 2 μg/kg in Natrium umgerechnet, was viel weniger ist als der Fehler der Messung selbst. Sie finden diese Programme in der Datei Fragment.xls, sie haben folgende tabellarische Form:
NaCl in Kontakt mit Luft:
Ist der Kohlendioxidgehalt in der Raumluft höher als berechnet, wird die aus diesen Bruchstücken berechnete NaCl-Konzentration überschätzt.
Nun zur Qualität unserer Daten. Bewahren Sie immer Ihre Originalinformationen auf. Wenn Sie die Messwerte des Geräts – elektrische Leitfähigkeit oder pH-Wert – aufgezeichnet haben, notieren Sie die Temperatur der gemessenen Lösung. Geben Sie beim pH-Wert an, ob der Temperaturkompensator während der Messung eingeschaltet war, und schauen Sie im Allgemeinen in der Anleitung des Geräts nach, was es tut, wenn die Probentemperatur von der Standardtemperatur abweicht. Wenn Sie den pH-Wert, die Leitfähigkeit oder die Hydratalkalität in einer Probe bestimmen, insbesondere in einer Probe mit einem hohen anfänglichen Kohlendioxidgehalt, bedenken Sie, dass Ihre Probe nicht mehr dieselbe ist wie bei der Entnahme. Eine unbekannte Menge Kohlendioxid ist bereits aus der Probe in die Luft gelangt oder umgekehrt.
Sie riefen einmal aus Winniza an und fragten, wie man den pH-Wert an die Temperatur anpassen könne. Dies kann das sein, was vor Ort getan werden sollte oder auch nicht. Notieren Sie in jedem Fall den anfänglichen pH-Wert und die Temperatur der Probe und stellen Sie eine separate Spalte für den eingestellten pH-Wert bereit.
Jetzt erfahren Sie, wie Sie den pH-Wert einstellen. Ich fürchte, dass nicht einmal hundert weise Männer diese „einfache“ Frage allgemein beantworten können. So sieht beispielsweise die Abhängigkeit des pH-Werts von der Temperatur für absolut reines Wasser aus.

Das Gleiche, aber in Kontakt mit Luft:


Es stellte sich jedoch heraus, dass die Korrektur des pH-Werts zur Temperatur für diese beiden Diagramme dieselbe war:

Der Übergang vom gemessenen pH-Wert zum pH-Wert bei t=25 °C kann für diese Diagramme mithilfe der Formel erfolgen:

Ein strengerer Ansatz wäre, nicht 1 und 3 mg/l freies Kohlendioxid, sondern 1 und 3 mg/l gesamtes (undissoziiertes und dissoziiertes) Kohlendioxid zu sich zu nehmen. Wenn Sie möchten, finden Sie dieses Fragment auf Blatt 4, die Ergebnisse für dieses Fragment werden sich jedoch nicht wesentlich von den auf diesem Blatt gezeigten unterscheiden.
Beachten Sie, dass sich die Anteile für Kohlendioxid auf Wässer beziehen, in denen außer Kohlendioxid keine Laugen oder Säuren und insbesondere kein Ammoniak vorhanden sind. Dies geschieht nur bei einigen Wärmekraftwerken mit Mitteldruckkesseln.