Расставление коэффициентов в уравнениях химических реакций. Карточка-информатор
Л егко ли расставлять коэффициенты в химических уравнениях?
егко ли расставлять коэффициенты в химических уравнениях?
Вот мои дети и доросли до химии (я классный руководитель в 8 «Б» классе). Химию чаще всего ребятам ставят на первом уроке , а в четверг у меня нет первого урока, и я попросился на урок к Валентине Ивановне «на детей посмотреть» и проверить дневники. Тема меня увлекла, в школе я любил химию, и дневники я не проверил. В очередной раз я убедился , что учащиеся чаще всего испытывают затруднения из-за того, что не видят межпредметных связей. На этом уроке химии учащиеся должны были составить химические уравнения, зная валентность химических веществ. И многие учащиеся испытали затруднения при определении числовых коэффициентов. Следующий урок химии в субботу мы с Валентиной Ивановной провели вместе.
Упражнение 1.
Запишите в виде химических уравнений следующие предложения:
А) «При обжиге карбоната кальция образуются оксид кальция и оксид углерода (IV)»; б) «При взаимодействии оксида фосфора (V) с водой получается фосфорная кислота».
Решение:
А) CaCO 3 = CaO + CO 2 - реакция эндотермическая. С этим заданием затруднений не оказалось, так как не нужно было подыскивать числовые коэффициенты. Изначально в левой и правой частях равенства по одному атому кальция по одному атому углерода и по три атома кислорода.
Б) P 2 O 5 + 3H 2 O = 2H 3 PO 4 - реакция экзотермическая. Со вторым уравнение возникли проблемы , без числовых коэффициентов не получилось верное равенство: P 2 O 5 + H 2 O → H 3 PO 4 . Очевидно , что для составления верного равенства нужно подбирать числовые коэффициенты. Если подбирать, то можно начать с фосфора: слева два атома, а справа – один, поэтому перед формулой азотной кислоты поставим числовой множитель, равный двум и тогда получим: P 2 O 5 + H 2 O → 2H 3 PO 4 . Но теперь осталось уравнять число атомов кислорода и водорода: водорода слева два атома , а справа - шесть атомов, поэтому перед формулой воды поставим числовой коэффициент, равный трём и тогда получим: P 2 O 5 + 3H 2 O → 2H 3 PO 4 . Теперь легко убедиться, что в каждой из частей уравнения равные количества и атомов фосфора и атомов водорода и атомов кислорода , следовательно, мы получили верное уравнение химической реакции: P 2 O 5 + 3H 2 O = 2H 3 PO 4 .
Второй способ: алгебраический. Предположим, что в уравнении поставили три коэффициента а, в, с , что получилось верное уравнение химической реакции: а P 2 O 5 + в H 2 O = с H 3 PO 4 . Так как в уравнении используются атомы трёх видов, то составим систему из трёх линейных уравнений с тремя неизвестными а, в и с .
Вещества, которые использовались в химической реакции: Р – фосфор; О 2 – кислород ; P 2 O 5 – оксид фосфора (V).
В) Fe 2 (SO 4) 3 + KOH → Fe(OH) 3 + K 2 SO 4 .
Вещества, которые использовались в химической реакции: Fe 2 (SO 4) 3 – сульфат железа (III); KOH – гидроксид калия; Fe(OH) 3 – гидроксид железа (III); K 2 SO 4 – сульфат калия.
Г) CuOH → Cu 2 O + H 2 O.
Решение:
2CuOH = Cu 2 O + H 2 O. Задачу по определению числовых коэффициентов решали , составляя систему уравнений: 
Вещества, которые использовались в химической реакции: CuOH – гидроксид меди (I); Cu 2 O – оксид меди (I); H 2 O – вода.
Д) CS 2 + O 2 → CO 2 + SO 2 .
Решение : CS 2 + 3O 2 = CO 2 + 2SO 2 . Решали подбором коэффициентов: уравняли число атомов серы (2); уравняли число атомов кислорода (3).
Вещества, которые использовались в химической реакции: CS 2 – сульфид серы (IV); O 2 –
Вещества, которые использовались в химической реакции: FeS 2 – колчедан; O 2 – кислород; Fe 2 O 3 – оксид железа (III); SO 2 - оксид серы (IV).
Упражнение 3.
(Было предложено для решения как самостоятельная работа).
Условие:
Запишите уравнения химических реакций по следующим схемам:
А) фосфорная кислота + гидроксид натрия → фосфат натрия + вода;
Б) оксид натрия + вода → гидроксид натрия;
В) оксид железа (II) + алюминий → оксид алюминия + железо;
Г) гидроксид меди (II)→ оксид меди (II) + вода.
Ответ:
А) 2H 3 PO 4 + 6NaOH = 2Na 3 PO 4 + 6H 2 O;
Б) Na 2 O + H 2 O = 2NaOH;
В) 3FeO + 2Al = Al 2 O 3 + 3Fe;
Г) Cu(OH) 2 = CuO + H 2 O.
За 10 минут 85% учащихся справились с заданием на «отлично», что приятно удивило Валентину Ивановну.
РАССТАНОВКА КОЭФФИЦИЭНТОВ
Число атомов одного элемента в левой части уравнения должно быть равно числу атомов этого элемента в правой части уравнения.
Задание 1 (для групп). Определите число атомов каждого химического элемента, участвующего в реакции.
1. Вычислите число атомов:
а) водорода: 8NH3, NaOH, 6NaOH, 2NaOH, НзРО4, 2H2SO4, 3H2S04, 8H2SO4;
6) кислорода : C02, 3C02, 2C02, 6CO, H2SO4, 5H2SO4, 4H2S04, HN03.
2. Вычислите число атомов: а) водорода:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
б) кислорода:
1) 2СО + 02 2) С02 + 2Н.О. 3)4NO2 + 2H2O + O2
Алгоритм расстановки коэффициентов в уравнениях химических реакций
А1 + О2→ А12О3А1-1 атом А1-2
О-2 атома О-3
2. Среди элементов с разным числом атомов в левой и правой частях схемы выбрать тот, число атомов которого больше
О-2 атома слева
О-3 атома справа
3. Найти наименьшее общее кратное (НОК) числа атомов этого элемента в левой части уравнения и числа атомов этого элемента в правой части уравнения
НОК = 6
4. Разделить НОК на число атомов этого элемента в левой части уравнения, получить коэффициент для левой части уравнения
6:2 = 3
Аl + ЗО 2 →Аl 2 О 3
5. Разделить НОК на число атомов этого элемента в правой части уравнения, получить коэффициент для правой части уравнения
6:3 = 2
А1+ О 2 →2А1 2 О3
6. Если выставленный коэффициент изменил число атомов еще какого-либо элемента, то действия 3, 4, 5 повторить еще раз.
А1 + ЗО 2 → →2А1 2 О 3
А1 -1 атом А1 - 4
НОК = 4
4:1=4 4:4=1
4А1 + ЗО 2 → →2А1 2 О 3
. Первичная проверка усвоения знаний(8-10 мин .).
В левой части схемы два атома кислорода, а в правой - один. Число атомов нужно выровнять с помощью коэффициентов.
1)2Mg+O 2 →2MgO
2) СаСО 3 + 2HCl→ СаСl 2 + Н 2 О + СО 2
Задание 2 Расставьте коэффициенты в уравнениях химических реакций (обратите внимание, что коэффициент изменяет число атомов только одного элемента ):
1. Fe 2 O 3 + А l → А l 2 О 3 + Fe; Mg + N 2 → Mg 3 N 2 ;
2. Al + S → Al 2 S 3 ; A1 + С → Al 4 C 3 ;
3. Al + Cr 2 O 3 → Cr + Al 2 O 3 ; Ca + P → Ca 3 P 2 ;
4. С + H 2 → CH 4 ; Ca + С → СаС 2 ;
5. Fe + O 2 → Fe 3 O 4 ; Si + Mg → Mg 2 Si;
6/.Na + S → Na 2 S; CaO + С → CaC 2 + CO;
7. Ca + N 2 → C a 3 N 2 ; Si + Cl 2 → SiCl 4 ;
8. Ag + S → Ag 2 S; Н 2 + С l 2 → НС l;
9. N 2 + O 2 → NO; СО 2 + С → СО ;
10. HI → Н 2 → + 1 2 ; Mg + НС l → MgCl 2 + Н 2 ;
11. FeS + НС 1 → FeCl 2 + H 2 S; Zn+ HCl → ZnCl 2 + H 2 ;
12. Br 2 + KI → KBr+ I 2 ; Si + HF (r) → SiF 4 + H 2 ;
1./ HCl+Na 2 CO 3 → CO 2 +H 2 O+ NaCl; KClO 3 + S → → KCl+ SO 2 ;
14. Cl 2 + KBr → KCl + Br 2 ; SiO 2 + С → Si + CO;
15. SiO 2 + С → SiC + CO; Mg + SiO 2 → Mg 2 Si + MgO
16 .
3.Что означает знак «+» в уравнении?
4. Зачем расставляют коэффициенты в уравнениях хим
Существует несколько методов определения коэффициентов в уравнениях окислительно-восстановительных реакций. Мы используем метод электронного баланса, при котором составление полного уравнения ОВР проводится в следующей последовательности:
1. Составляют схему реакции, указав вещества, вступившие в реакцию, и вещества, получившиеся в результате реакции, например:
2. Определяют степень окисления атомов и пишут ее знак и величину над символами элементов, отмечая элементы, степень окисления которых изменилась:
3. Записывают электронные уравнения реакций окисления и восстановления, определяют число электронов, отданных восстановителем и принятых окислителем, и затем уравнивают их, умножая на соответствующие коэффициенты:
4. Полученные коэффициенты, отвечающие электронному балансу, переносят в основное уравнение:
5.Уравнивают число атомов и ионов, не меняющих степени окисления (в последовательности: металлы, неметаллы, водород):
6.Проверяют правильность подбора коэффициентов по числу атомов кислорода в левой и правой части уравнения реакции – они должны быть равны (в этом уравнении 24 = 18 + 2 + 4, 24 = 24).
Рассмотрим более сложный пример:
Определим степени окисления атомов в молекулах:
Составим электронные уравнения реакций окисления и восстановления и уравняем число отданных и принятых электронов:
Перенесем коэффициенты в основное уравнение:
Уравняем число атомов, не меняющих степень окисления:
Подсчитав число атомов кислорода в правой и левой части уравнения, убедимся, что коэффициенты подобраны правильно.
Важнейшие окислители и восстановители
Окислительно-восстановительные свойства элементов зависят от строения электронной оболочки атомов и определяются их положением в периодической системе Менделеева.
Металлы, имея на внешнем энергетическом уровне 1-3 электрона, легко их отдают и проявляют только восстановительные свойства. Неметаллы (элементы IV-VII групп) могут как отдавать, так и принимать электроны, поэтому они могут проявлять и восстановительные и окислительные свойства. В периодах с увеличением порядкового номера элемента восстановительные свойства простых веществ ослабевают, а окислительные усиливаются. В группах с повышением порядкового номера восстановительные свойства усиливаются, а окислительные ослабевают. Таким образом, из простых веществ лучшими восстановителями являются щелочные металлы, алюминий, водород, углерод; лучшими окислителями являются галогены и кислород .
Окислительно-восстановительные
свойства сложных веществ зависят от
степени окисления атомов, входящих в
их состав. Вещества,
содержащие атомы с низшей степенью
окисления, проявляют восстановительные
свойства
.
Важнейшими восстановителями являются
оксид углерода
 ,
сероводород
,
сероводород ,
сульфат железа(II)
,
сульфат железа(II)
 .Вещества,
в состав которых входят атомы с высшей
степенью окисления, проявляют окислительные
свойства
.
Важнейшими окислителями являются
перманганат калия
.Вещества,
в состав которых входят атомы с высшей
степенью окисления, проявляют окислительные
свойства
.
Важнейшими окислителями являются
перманганат калия
 ,
дихромат калия
,
дихромат калия ,
пероксид водорода
,
пероксид водорода ,
азотная кислота
,
азотная кислота ,
концентрированная серная кислота
,
концентрированная серная кислота .
.
Вещества,
содержащие атомы с промежуточной
степенью окисления, могут вести себя
как окислители или восстановители
в зависимости от свойств веществ, с
которыми они взаимодействуют, и условий
протекания реакции. Так в реакции с
 сернистая кислота проявляет
восстановительные свойства:
сернистая кислота проявляет
восстановительные свойства:
а при взаимодействии с сероводородом является окислителем:

Кроме того, для таких веществ возможны реакции самоокисления-самовосстановления, протекающие с одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента, например:
Сила многих
окислителей и восстановителей зависит
от рН среды. Например,
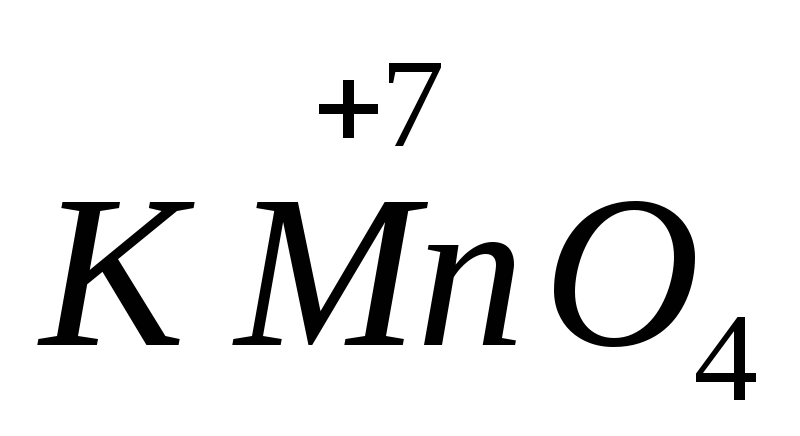 в щелочной среде восстанавливается до
в щелочной среде восстанавливается до ,
в нейтральной до
,
в нейтральной до ,
в присутствии серной кислоты - до
,
в присутствии серной кислоты - до .
.
Уравнением реакции в химии называется запись химического процесса с помощью химических формул и математических знаков.
Такая запись является схемой химической реакции. Когда возникает знак «=», то это называется «уравнение». Попробуем его решить .
Пример разбора простых реакций
В кальции один атом, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. С правой стороны уравнения Са тоже один. По кальцию нам не надо работать.
Смотрим следующий элемент - кислород. Индекс 2 говорит о том, что здесь 2 иона кислорода. С правой стороны нет индексов, то есть одна частица кислорода, а с левой – 2 частицы. Что мы делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты – это то, что написано перед наименьшей частью. Они имеют право меняться. Для удобства саму формулу не переписываем. С правой части один умножаем на 2, чтобы получить и там 2 иона кислорода.

После того как мы поставили коэффициент, получилось 2 атома кальция. С левой стороны только один. Значит, теперь перед кальцием мы должны поставить 2.

Теперь проверяем итог. Если количество атомов элементов равно с обеих сторон, то можем поставить знак «равно».

Другой наглядный пример: два водорода слева, и после стрелочки у нас тоже два водорода.

- Два кислорода до стрелочки, а после стрелочки индексов нет, значит, один.
- Слева больше, а справа меньше.
- Ставим коэффициент 2 перед водой.

Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось два атома водорода. И чтобы получить 4, мы должны водород умножить на два.

Вот тот случай, когда элемент в одной и в другой формуле с одной стороны, до стрелочки.

Один ион серы слева, и один ион - справа. Две частицы кислорода, плюс еще две частицы кислорода. Значит, что с левой стороны 4 кислорода. Справа же находится 3 кислорода. То есть с одной стороны получается четное число атомов, а с другой – нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. Для этого умножаем на два всю формулу после стрелочки. После умножения получаем шесть ионов кислорода, да еще и 2 атома серы. Слева же имеем одну микрочастицу серы. Теперь уравняем ее. Ставим слева уравнения перед серой 2.

Уравняли .
Сложные реакции
Этот пример более сложный, так как здесь больше элементов вещества.

Это называется реакцией нейтрализации. Что здесь нужно уравнивать в первую очередь:
- С левой стороны один атом натрия.
- С правой стороны индекс говорит о том, что здесь 2 натрия.
Напрашивается вывод, что надо умножить всю формулу на два.

Теперь смотрим, сколько серы. С левой и правой стороны по одной. Обращаем внимание на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5 . Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем 2.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны также 6 атомов. Проверяем водород. Два атома водорода и еще 2 атома водорода. То есть будет четыре атома водорода с левой стороны. И с другой стороны также четыре атома водорода. Все элементы уравнены. Ставим знак «равно».

Следующий пример.

Здесь пример интересен тем, что появились скобки. Они говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на него. Начать необходимо с азота, так как его меньше, чем кислорода и водорода. Слева азот один, а справа, с учетом скобок, его два.

Справа два атома водорода, а нужно четыре. Мы выходим из положения, просто умножая воду на два, в результате чего получили четыре водорода. Отлично, водород уравняли. Остался кислород. До реакции присутствует 8 атомов, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».

Последний пример .

На очереди у нас барий. Он уравнен, его трогать не нужно. До реакции присутствует два хлора, после нее – всего один. Что же нужно сделать? Поставить 2 перед хлором после реакции.

Теперь за счет коэффициента, который только что поставлен, после реакции получилось два натрия, и до реакции тоже два. Отлично, все остальное уравнено.

Также уравнивать реакции можно методом электронного баланса. Этот метод имеет ряд правил, по которым его можно осуществлять. Следующим действием мы должны расставить степени окисления всех элементов в каждом веществе для того, чтобы понять где произошло окисление, а где восстановление.
Преподаватель, являясь главным действующим лицом в организации познавательной деятельности учащихся, постоянно находится в поиске путей повышения эффективности обучения. Организация эффективного обучения возможна только при знании и умелом использовании разнообразных форм педагогического процесса.
1. Современный человек должен обладать, не только суммой знаний и умений, но и способностью воспринимать мир как единое, сложное, постоянно развивающееся целое.
Скачать:
Предварительный просмотр:
Статья по химии: «Расстановка коэффициентов в химических уравнениях»
Составила: учитель химии
ГБОУ СОШ № 626
Казутина О.П.
Москва 2012
«Расстановка коэффициентов в химических уравнениях»
Преподаватель, являясь главным действующим лицом в организации познавательной деятельности учащихся, постоянно находится в поиске путей повышения эффективности обучения. Организация эффективного обучения возможна только при знании и умелом использовании разнообразных форм педагогического процесса.
1. Современный человек должен обладать, не только суммой знаний и умений, но и способностью воспринимать мир как единое, сложное, постоянно развивающееся целое.
Алгоритм работы по подготовке к проведению урока
выбор темы, определение целеполагания;
отбор содержания;
определение средств и путей развития у учащихся положительной мотивационной установки к работе на уроке;
конкретизация оснащения урока необходимым наглядным и дидактическим материалом;
разработка конспекта урока
Пример урока химии «Расстановка коэффициентов в химическом уравнении» для учителей
Цель: ответить на вопрос: «для чего надо расставлять коэффициенты в химическом уравнении»
Задачи:
Проблема необходимости расстановки коэффициентов
Алгоритм расстановки коэффициентов
Доказательство смысла расстановки коэффициентов
Ход урока:
Современный ученик, если он и учится, то относится к получаемым и перерабатываемым знаниям с прагматичностью. Поэтому предоставляемый материал должен уложиться в голове логично и лаконично.
Чтобы этого добиться, учителю всегда следует обращать внимание на то, зачем надо усвоить на уроке то или иное действие. То есть учитель должен объяснить. А потом, по – хорошему, дождаться правильных вопросов по новой теме.
Закон сохранения массы веществ
Знаменитый английский химик Р. Бойль, прокаливая в открытой реторте различные металлы и взвешивания их до и после нагревания, обнаружил, что масса металлов становится больше. Основываясь на этих опытах, он не учитывал роль воздуха и сделал неправильный вывод, что масса веществ в результате химических реакций изменяется. Р. Бойль утверждал, что существует какая-то "огненная материя", которая в случае нагревания металла соединяется с металлом, увеличивая массу.
Mg + O 2 MgO
24 г
40 г
М. В. Ломоносов в отличие от Р. Бойля прокаливал металлы не на открытом воздухе, а в запаянных ретортах и взвешивал их до и после прокаливания. Он доказал, что масса веществ до и после реакции остается без изменения и что при прокаливании к металлу присоединяется какая-то часть воздуха. (Кислород в то время не был еще открыт.) Результаты этих опытов он сформулировал в виде закона: "Все перемены,в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимается столько присовокупится к другому". В настоящее время этот закон формулируется так:
Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ
Mg + O 2 MgO
24 г 32 г 40 г
Вопрос: закон не выполняется (т.к. не равны массы исходных и конечных веществ).
Решение этой проблемы – расстановка коэффициентов (целых чисел, показывающих количество молекул):
2Mg + O 2 2MgO
48 г 32 г 80 г – массы до и после равны благодаря тому, что число атомов элементов тоже равно до и после реакции.
Таким образом, доказав учащимся необходимость уравнивания масс коэффициентов, можно даже обойтись без некоторых предыдущих тем: составления формул веществ по валентности, расчета массы, количество вещества…Также рассказ о том, что закон сохранения массы вещества 20 лет спустя «переоткрыл» А. Лавуазье, уточнив его с одной стороны, но совершенно не обратив внимания на М.В. Ломоносова с этической, можно оставить на самостоятельное изучение в виде доклада, например.
Итак, для успешного выполнения заданий такого рода, необходимо усвоить условие: число атомов до реакции дб равно числу атомов после реакции: решим вместе:
H 2 S + 3O 2 SO 2 + 2H 2 O (удваиваем кислороды справа. Считаем их слева)
СН 4 + 2О 2 СО 2 + 2Н 2 О
Мы расставили коэффициенты в уравнениях горения двух газов




