グループ 5 の主要サブグループの元素の化学。 V A 族元素の一般的特徴
V 族元素には、窒素 7N、リン 15P、ヒ素 33As、アンチモン 51Sb、ビスマス 83Bi が含まれます。 ハロゲンやカルコゲンとの類推により、それらの一般名は「プニクトゲン」(ギリシャ語から翻訳されたもので、窒息するような不快な臭いを持ち、特にこれらの元素の水素化合物を指します)と提案されています。
基底状態では、V A 族元素の原子は、3 つの不対 p 電子を持つ外層 ns2nр3 の電子配置を持っています。 N – P – As – Sb – Vi の系列では、原子サイズが増加し、イオン化エネルギーが減少するため、金属特性が増加します。遊離型では、窒素とリンは典型的な非金属であり、アルセンとアンチモンは半金属であり、ビスマスは金属です。金属。 半径が増加すると、原子の配位数 (CN) も増加します。 窒素は 1 ~ 4 の配位数を特徴とし、リンは通常 4 の配位数を持ちますが、ハロゲンを含む化合物では配位数が 6 に達することもあり、アルセンとアンチモンは 4.6 の配位数を示し、ビスマスは 7 の配位数を持ちます。 、8、9。
窒素は、半径が小さく電気陰性度が高いため、そのサブグループの他の元素とは異なります。 エネルギー的にアクセス可能な空の d 副準位が存在しないため、窒素原子はドナー - アクセプター機構による 1 つの結合を含め、4 つしか共有結合を形成できないという事実につながります。
原子半径の増加と原子の p 軌道の重なりの減少により、N-P-As-Sb-Bi シリーズの単一 σ 結合の強度が減少します。 P-P 結合と比較して N-N 結合の強度が低いのは、窒素原子のサイズが小さいことと、その結果生じる強い電子反発によるものです。 逆に、多重結合の強度は、原子軌道のサイズが大きくなるにつれて減少し、その結果、π型との重なりが弱まります。 したがって、窒素の複数 (三重) 結合が最も強力です。 リンとヒ素の場合、単結合の形成はエネルギー的により有利です。
V A 族元素は異なる酸化状態を示します。 窒素は、-3 から +5 (-3、-2、-1、+1、+2、+3、+4、+5) までのスペクトル全体によって特徴付けられます。 リンの場合、負の酸化状態は窒素ほど特徴的ではありません。 同時に、酸化度の高い化合物の安定性が高まり、リン原子の電気陰性度の低下、イオン化エネルギーの低下、結合強度の増加につながります。 化合物中のヒ素とアンチモンの酸化状態は -3、+3、+5 であり、ビスマスの場合、酸化状態が +3 の化合物は安定です。
+3 酸化状態にある V A 族の元素は非共有電子対を保持しており、これが化学量論とドナー特性を決定します。
さまざまな要因の組み合わせ作用(原子半径の増加、pπ-pπ 重なりの減少、外部電子の遮蔽度の増加)により、サブグループの以下の元素に対するリン化合物の安定性と酸化能力は非依存的に変化します。単調 (二次周期性) - リンとアンチモンでは最高の酸化状態が最も安定しますが、酸化状態 +5 のヒ素、特にビスマスの化合物は不安定であるか、まったく存在しないことがよくあります。 ビスマス (V) 化合物は強力な酸化剤です。
リンの酸素化合物、および程度は低いですが、グループの次の元素では、pπ-dπ が発生し、E-O 結合の多重度が増加し、そのエネルギーが増加します。 したがって、同様の窒素化合物とは対照的に、リン化合物は実際には酸化特性を示しません。
4.2 自然の中にいること
窒素 N2 という単体の物質の形では、自然界には窒素のみが存在します (空気中の窒素含有量は約 78%)。 地殻中の窒素含有量は 2.5 · 10-3 wt.% です。 天然ミネラルのうち、チリ産硝酸塩 (NaNO3) と硝酸カリウム (KNO3) は産業上重要です。
リンはリン酸塩の形で存在し、地殻中のその含有量は 0.1 wt.% です。 最も一般的なミネラルはアパタイト、ヒドロキソアパタイト Ca5 (PO4) 3OH、フルオロアパタイト Ca5 (PO4) 2F、およびリン鉱石 Ca3 (PO4) 2 です。
ヒ素 (1.5 10-4 wt.%)、アンチモン (2 10-5 wt.%)、ビスマス (5 10-6 wt.%) 主に硫化物の形で存在します - 鉱石 As2S3、輝安鉱または輝晶輝石 Sb2S3、ビスマス光沢のあるBi2S3、硫黄鉄鉱FeAsS、テトラジマイトBi2Te2S、および酸素化合物、例えばボロナイトFeAsO4・2H2O、ビスマス黄土色Bi2O3など。
4.3 物理的性質と同素性
通常の条件下では、窒素 N2 は無色、無臭、無味の気体で、水に溶けます (0 °C で 2.3 ml / 100 g H2O)。 N2 分子の強い分子内結合、小さいサイズ、無極性が分子間相互作用の弱い理由であり、そのため窒素の融点と沸点は低くなります (それぞれ -210℃ と -1960℃)。
V A 族の他のすべての元素は、室温ではいくつかの同素体修飾を伴う固体です。
リンには、白、赤、黒の 3 つの同素体修飾が知られています。
白リンはワックスに似た柔らかい結晶質の物質で、不快なニンニク臭があります。 白リンは非常に有毒で化学的に活性があり、空気中で容易に自然発火するため、実質的に不溶性の水層の下に保管されます。 二硫化炭素CS2によく溶けます(この溶液で壁に文字を書いたり、キャンドルの芯を湿らせたりすると、しばらくすると二硫化炭素の蒸発により、壁にあった目に見えない文字が見えるようになります。キャンドルは自動的に密閉されます)。 白リンには分子格子があり、その節点に四面体 P4 分子があります。 白リンは強力な毒であり、空気に触れずに320℃に加熱すると赤リンに変化します。
赤リンは白リンとは異なり、毒性がなく、二硫化炭素に溶けず、暗闇で光りません。 赤リンは、2 つのリン原子の架橋によって接続されたグループ P8 と P9 で構成されています。 赤リンの活性は低くなります。
黒リンは最も安定した変態であり、白リンを 220 °C まで加熱し、非常に高い圧力 (1200 気圧) で生成させます。 見た目はグラファイトに似ており、半導体です。
ヒ素、アンチモン、ビスマスは、リンと同様に、いくつかの修飾の形で存在します。 黄ヒ素 As4 は白リンと構造が似ています。 保管中に、より安定した六角形の形状に自発的に変化し、その構造は黒リンを彷彿とさせます。 また、アンチモンやビスマスにとっても最も安定です。
リンからビスマスへ向かうにつれて配位数が増加し、金属光沢が現れ、脆さが減少し、導電性が増加します。
4.4 単体の入手方法
産業では、窒素は液化空気を分別することによって得られます。 これを行うには、空気を高圧下で液体状態に変換し、その後、より軽い成分である酸素から蒸発によって窒素を分離します(窒素の場合、沸点 = -195.8 °C、酸素の場合、沸点 = -183 °C) )。
実験室では、窒素は亜硝酸アンモニウム、アジ化リチウムの熱分解、または亜硝酸ナトリウムと塩化アンモニウムの混合溶液の加熱によって得られます。
NH4NO2 → N2 + 2H2O;
2LiN3 → 3N2 + 2Li;
NaNO2 + NH4Сl → N2 + 2H2O + NaСl (この反応の結果として形成される窒素は硝酸や一酸化窒素の不純物で汚染されている可能性があり、それらを除去するためにガスを K2Сr2О7 の酸性溶液に通します)。
リンは、粉砕した亜リン酸塩またはアパタイトと砂および石炭の混合物を、電気炉内で空気のアクセスを行わずに 15000℃ の温度で焼成することによって工業的に製造されます。
Ca3 (PO4) 2 + 3SiO2 + 5C → 3CaSiO3 + 2P + 5CO。
リンは蒸気として放出され、水中の受器内で白リンとして凝縮します。
リン酸塩に加えて、例えばメタリン酸塩を削減することが可能である。
ヒ素、アンチモン、ビスマスは、硫化鉱石を焙煎し、その後コークスで酸化物を還元することによって得られます。
2 E2S3 + 9 O2 → 6 SO2 + 2 E2O3;
2 E2O3 + 3 C → 2 E + 3 CO。
4.5 単純な化合物の化学的性質
単体物質との相互作用:
窒素分子は、N2 分子内に三重結合が存在することと、分子が無極性であるため、反応性が非常に低くなります。 室温では、窒素はリチウムとのみ反応しますが、多くの金属とともに、たとえば 300°C で加熱すると、次のように反応します。
3Mg + N2 → Mg3N2
窒化マグネシウム
電気アークの温度 (約 3000°C) では、窒素は酸素と相互作用します: N2 + O2 → 2NO。
温度約 450°C、圧力 30 MPa、触媒 (Fe または Al2O3) の存在下で、窒素は水素と反応してアンモニアを生成します。
N2 + 3H2 → 2NH3。
P、As、Sb、Vi は窒素よりも反応性が高くなります。 したがって、空気中で燃焼すると、リンは無水リン酸塩 P2O5 (酸素が欠乏している - P4O6) を形成します。
4P + 5O2 → 2P2O5 – 酸化リン (V)
As、Sb、Vi は酸化されて三酸化物 E2O3 になります。
ハロゲンとの反応も集中的に起こります。
2E + 3Cl2 → 2ЕCl3。
塩素が過剰になると、リン、アンチモンが ECl5 五塩化物を形成します。
不活性雰囲気中で金属を加熱すると、P、As、Sb、Vi はそれぞれリン化物、ヒ化物、アンチモン化物、ビスマス化物 (化学量論的および非化学量論的) を形成します。
3Ca + 2P → Ca3P2 – リン酸カルシウム。
4.6 V A 族元素の水素化合物
酸化状態 -3
V A 族のすべての元素は水素と EN3 化合物を形成しますが、その安定性は異なります。 スチビン SbH3、特にビスムチン BiH3 は非常に不安定です。 室温では、V A 族元素の水素化物は特徴的な刺激臭を持つ無色の気体です。 EN3 分子は三角錐の形状をしています。
NH3 – РH3 – AsH3 – SbH3 – BiH3 の系列では、E 原子の半径が大きくなるにつれて E-H 結合の長さも長くなります。 同時に、軌道の重なりが減少し、E-H 結合の強度と EN3 分子の安定性が低下します。 水素化物形成反応はアンモニアのみ発熱を伴いますが、アンモニアでも 4000℃ の温度ですでに分解します。 BiH3 は 250℃ の温度で数分間しか存在しません。
NH 結合は非常に極性があり、これは窒素の高い電気陰性度、アンモニアの分子軌道に対する窒素原子軌道の寄与が大きいこと、および総双極子モーメントが大きいことで説明されます。 非結合電子対のドナー特性が低下すると、ホスフィンの場合は EN4 + イオンを形成する能力が大幅に低下し、アルシンの場合は事実上存在しません。
NH3 – РH3 – АsH3 – SbH3 系列の融点と沸点は非単調に変化します。 他の水素化物の場合、水素結合の存在に伴う高温の NH3 相転移は存在しません。 pH3 から SbH3 への移行中の融解温度と沸騰温度の上昇は、分子間相互作用の増加に関連しています。
抽出: 工業における単体物質の相互作用により、次の反応によりアンモニア NH3 のみが得られます。
N2 + 3H2 → 2NH3。
アンモニアの工業的合成はドイツの化学者 F. ハーバーによって導入され、1918 年にこれによりノーベル賞を受賞しました。 反応は400〜500℃の温度および高圧(装置に応じて10〜300気圧)で行われる。 反応をスピードアップするために、触媒が追加されます-スポンジ鉄にカリウム、カルシウム、マグネシウム、酸化ケイ素を加えたものです。
実験室では、以下の反応に従って加熱することによりアンモニアが生成されます。
2NH4Cl + Ca(OH) 2 → CaCl2 + 2NH3 + 2H2O。
ホスフィン pH3 (腐った魚の臭いのある透明なガス) は通常、次の反応によって得られます。
4P + 3NaOH + 3H2O → PH3 + 3NaH2PO2;
Ca3P2 + 5HCl → 3CaCl2 + 2PH3。
水素化ヒ素またはアルシノエ AsH3 (ニンニクのような臭いを持つ透明で非常に有毒なガス) は、ヒ素化合物の還元によって生成されます。
As2O3 + 6Zn + 6H2SO4 → 2AsH3 + 6ZnSO4 + 3H2O
トラブゾンは不安定で、加熱すると水素と遊離ヒ素に分解し、デバイスの冷たい部分 (アルセンミラー) に黒いコーティングを形成します。これはヒ素に対する定性的な反応です。
水素化合物 EN3 の場合、最も特徴的な反応は水との相互作用、酸化反応、水素原子の置換です。
アンモニアからホスフィンに移行すると、水への溶解度や塩基性が急激に低下します。 ホスフィン、アルシノエ、スチビンは水に溶けにくい物質です。 水溶液では、それらは実際には塩基性特性を示さない。 ホスフィンは同時に酸でもあります (ただし、酸性は非常に弱い)。活性金属はその中の 1 つの水素を置き換えてホスホニド MePH2 を形成します。
アンモニアは、他のピクトジェニックスの水素化物とは異なり、水に非常に溶けやすく(1体積の水に1,200体積のNH3を溶解します)、これは水素結合の形成とさまざまな組成のNH3・nH2O水和物によって説明されます。 アンモニアは蒸発しやすいため、薄めた溶液でも独特の臭いがします。
アンモニア水溶液は弱塩基の性質を示します。
NH3 + H2O ↔ NH4 + + OH-
遊離の sp2 ハイブリッド電子対の存在は、そのドナー特性、つまり酸と相互作用してアンモニウム塩を形成したり、複雑な化合物を形成したりする能力、つまりアンモニアをもたらします。
NH3 + HCl → NH4Cl
NiCl2 + 6 NH3 → Cl2。
アンモニウム塩は熱安定性が低いという特徴があり、加熱すると酸残基に応じてさまざまな生成物に分解します。
アルカリ金属はアンモニアと反応してアミドを形成します。
NH3 + Na → NaNH2 + 1/2 H2
他の金属はアンモニアと反応して窒化物を形成します。
3Мg + 2 NH3 → 3МgN3 + 3 H2
化学量論的窒化物に加えて、TiN などの非化学量論的化合物の形成も可能です。
フッ素はアンモニアを瞬時にNF3に酸化します。 他のハロゲンが存在すると水素原子が置換され、その反応生成物は生成される化合物の酸性度、温度、安定性に依存します。
修復特性:
EN3 の元素の原子は最も低い酸化段階にあるため、水素化物は還元特性を示します。
アンモニアは空気中では燃えませんが、酸素雰囲気中では燃えます。
– 触媒なし: 4NH3 + 3O2 → 2N2 + 6H2O。
– 白金触媒を使用した場合: 4NH3 + 5O2 → 4NO + 6H2O。
ホスフィンは空気と爆発性混合物を形成し、発火すると燃えてメタリン酸を形成します。
РH3 + 2O2 → HPO3 + H2O。
トラブゾンとスチビンは燃焼すると三酸化物を形成します。
2 EH3 + 3 O2 → E2O3 + 3H2O。
高温では、アンモニアは一部の金属酸化物を還元できます。
2NH3 + 3CuO → 3Cu + N2 + 3H2O。
ホスフィン、アルシノエ、スチビンは強力な還元剤であり、重金属塩を還元します。
アンモニウム塩はホスホニウム塩よりも安定です。 酸、アルカリ、その他の塩と相互作用する可能性があります
NH4Cl + HNO3 → NH4NO3 + HCl;
2NH4Cl + Ba (OH) 2 → 2NH3 + 2H2O + BaCl2;
(NH4) 2SO4 + BaCl2 → BaSO4 ↓ + 2NH4Cl。
アニオンが酸化剤ではないアンモニウム塩は、加熱すると分解して戻ります。
NH4Cl ↔ NH3 + HCl
(NH4) 2SO4 ↔ 2NH3 + Н2SO4
アニオンが酸化剤の場合、塩は完全に分解します。
NH4NO3 → N2O + 2H2O。
金属リン化物は水の影響で完全に加水分解します。
Mg3P2 + 6H2O → 3Mg (OH) 2 + 2PH3。
アンモニアに加えて、窒素は水素と他の化合物、たとえばヒドラジン N2H4 (窒素酸化状態 2) を形成します。 ヒドラジンは、アンモニアのような刺激臭のある液体で、イオン化が可能で、アンモニアより弱い塩基であり、非常に強力な還元剤です。 НN3 – 硝酸(窒素の正式な酸化状態は -1/3 – НNN2、1 つの窒素原子の酸化状態は +5、もう 1 つは -3) - 無色の液体で刺激臭があり、爆発性があります。 非常に強力な還元剤であり、非常に強い酸です。
4.7 V A 族元素の酸素化合物
酸素窒素化合物
窒素と酸素は、N2O、NO、N2O3、NO2、N2O4、N2O5 の 6 つの酸化物を形成します (さらに、さらに 2 つの不安定な酸化物が知られています: N4O、NO3)。 最初の 2 つの酸化物は塩水ではありません。 他のものは、水と相互作用すると、対応する酸、亜硝酸塩と硝酸塩を形成します。
すべての窒素酸化物は、さまざまな活性を持つ金属と硝酸の相互作用、または温度での硝酸塩の分解によって得られます。 NO のみが、高温で単体物質から直接合成することによって得られます (雷放電中に大気中でも生成されます)。
酸化状態+1:
酸化窒素 (I) である N2O は、甘味のある透明で無臭の気体で、水に溶けます。 大量に吸入すると神経系を興奮させるため、「笑気ガス」とも呼ばれます。
N2O は 200℃ で硝酸アンモニウムが分解して得られます。
NH4NO3 → N2O + 2H2O。
N2O は水、酸、アルカリとは反応しません。 酸化特性を持っていますが、強力な酸化剤と相互作用すると還元剤として機能します。
2N2O + 6Сl2 → 4NCl3 + O2。
酸化状態 +2:
酸化窒素 (II)、NO は透明な気体で、水に溶けますが、水とは反応しません。
実験室では、次の反応によって得られます。
3Cu + 8HNO3 → 3Cu (NO3) 2 + 2NO + 4H2O。
工業的には、NO は、700 ℃ で白金ロジウム触媒上で NH3 を接触酸化することによって得られます。
4NH3 + 5O2 → 4NO + 6H2O。
反応では、一般に NO は還元特性を示します。NO は KMnO4 溶液を変色させ、酸素によって容易に酸化されます。
2NO + O2 → 2NO2。
しかし、酸化剤になることもあります。
2NO + 2H2 → N2 + 2H2O。
酸化状態+3:
窒素 (iii) 酸化物、N2O3 は濃青色の液体です (気体状態と固体状態が同時に存在します)。 低温ではすでに NO と NO2 に分解されます。
N2O3 → NO + NO2。
水と N2O3 は亜硝酸を形成します: N2O3 + H2O → 2HNO2。
HNO2 は弱くて不安定な酸であり、酸化還元二重性を示し、希薄な溶液中にのみ存在し、温度の上昇とともに分解します。
3HNO2 → HNO3 + 2NO + H2O。
酸化状態 +4:
酸化窒素 (IV)、NO2 は特有の臭気を持つ茶色の気体で、水によく溶けます。 NO2 は冷却されると二量体化し、無色の液体 N2O4 を形成します。
これは、銅を濃硝酸にさらすか、マグネシウムから銅までの電圧範囲にある金属硝酸塩を加熱する際の分解によって得られます。
Cu + 4HNO3 → Cu (NO3) 2 + 2NO2 + 2H2O;
2Pb (NO3) 2 → 2PbO + 4NO2 + O2。
NO2 と水の相互作用は次のように書くことができます。
6NO2 + 2H2O → 4HNO3 + 2NO。
NO は空気中の酸素によって酸化されるため、過剰な空気の存在下での NO2 と水の反応生成物は硝酸だけです。
4NO2 + O2 + 2H2O → 4HNO3。
この反応は、工業的に硝酸を生成するために使用されます。
NO2 は強力な還元剤であり、大気中で硫黄、炭素、および多くの金属が燃焼します。 水に溶解するとこれらの酸の混合物を形成するため、硝酸と亜硝酸の混合無水物と考えることができます。
2NO2 + H2O → HNO2 + HNO3
亜硝酸態窒素
酸酸
酸化状態+5:
酸化窒素 (V) または無水硝酸、N2O5 は白色固体の結晶性物質であり、強力な酸化剤であり、酸性の特性を示します。水に溶解すると硝酸を形成し、アルカリと硝酸の塩、つまり硝酸塩を形成します。
N2O5 は次の反応によって得られます。
2HNO3 + P2O5 → 2HPO3 + N2O5;
加熱すると、次の方程式に従って分解します。
2N2O5 → 4NO2 + O2。
HNO3 – 硝酸または硝酸 – 刺激臭のある揮発性の無色の液体で、任意の割合で水と混和します。融点 = -420℃、沸点 = 830℃。
温度が上がると分解してNO2を放出し、黄色に変わります。
4HNO3 → 4NO2 + O2 + 2H2O。
初めて硝酸がU.F.によって得られた。 硝石に硫酸を作用させたグラウバー。 現在、この方法は実験室で硝酸を得るために使用されています: NaNO3 + H2SO4 → NaHSO4 + HNO3。
業界では、硝酸の製造にアンモニア法 (4NH3 + 5O2 4NO + 6H2O) が使用されています。
4NO + 2O2 → 4NO2
4NO2 + O2 + 2H2O 4HNO3
アンモニア法では50%の硝酸が得られます。 H2SO4 の存在下で 50% 硝酸を蒸留すると、98% HNO3 が得られます。 硝酸もアーク法によって生成されます。このプロセスの最初の段階では、30,000℃で単体物質から NO が生成されます。
硝酸は強力な電解質であり、強力な酸化剤であるため、一部の金属は硝酸の作用により不動態化され、その他の金属はさまざまな酸化状態で硝酸の窒素を還元します(還元剤の性質と酸の濃度に応じて異なります)。 )しかし、金属は硝酸溶液の水素を置き換えることはありません。
濃硝酸は最も強力な酸化特性を持っています。
アルカリ金属およびアルカリ土類金属 Na、Ca、Ba、Mg を使用すると、N2O に還元されます。例:
Mg + 10HNO3 (濃) → 4Мg (NO3) 2 + N2O + 5H2O
たとえば、重金属を使用すると、Cu、Ag、Hg は NO2 に還元されます。
Cu + 4HNO3 (濃) → Cu (NO3) 2 + 2NO2 + 2H2O
Fe、Cr、Al、Au、Ptとは相互作用しません。
希硝酸
アルカリ、アルカリ土類金属、Fe は NH3 (NH4NO3) に還元されます。例:
4Mg + 10HNO3 (ブレーカー) → 4Mg (NO3) 2 + NH4NO3 + 5H2O
– 重金属の場合、Cu、Ag、Hg は NO に還元されます。例:
3Cu + 8HNO3 (分解) → 3Cu (NO3) 2 + 2NO + 4H2O
非金属 (C、S、P、Si) が濃硝酸と相互作用すると、窒素は NO2 に還元され、希硝酸では NO に還元されます。次に例を示します。
5HNO3 (濃) + P → H3PO4 + 5NO2 + H2O;
5HNO3 (ブレーカー) + 3P + 2H2O → 3H3PO4 + 5NO。
濃硝酸1倍、濃塩酸3倍を混ぜたものを「濃い(王室、王室の)水」、「ロイヤルウォッカ」といいます。 硝酸と相互作用しない貴金属でさえ、この混合物に溶解します(これは、非常に強力で不安定な酸化剤 NOCl - 塩化ニトロシルの形成によって説明されます)。
Au + HNO3 + 4HCl → H + NO + 2H2O
3Pt + 4HNO3 + 18HCl → 3H2 + 4NO2 + 8H2O
硝酸の塩、硝酸塩は水によく溶け、加熱すると酸素を放出して分解します。
アルカリ金属およびアルカリ土類金属の硝酸塩は亜硝酸塩に分解します。
2NaNO3 → 2NaNO2 + O2;
Mg から Cu までの電圧範囲の金属の硝酸塩は金属酸化物に分解します: 2Pb (NO3) → 2PbO + 4NO2 + O2。
最も活性の低い金属(銀、金、プラチナ)の硝酸塩は、加熱すると分解して金属を遊離します。
2AgNO3 → 2Ag + 2NO2 + O2。
リン、ヒ素、アンチモン、ビスマスの酸素化合物
酸化状態+3
E2O3 酸化物は、単体物質と酸素の相互作用によって生成されます。 ただし、As、Sb、Bi の場合、酸素が過剰でも酸化物が形成される場合は、リンの酸化プロセスを厳密に制御する必要があります。 リン (iii) 酸化物 P2O3 (非共有電子対の存在により、二量体 P4O6 として存在します)。 P4O6 – 白色の緩い結晶性物質 (沸点 = 174°C、融解 = 24°C)、50 °C および 90 mm でのリンのゆっくりとした酸化中に形成されます。
20〜50℃の温度範囲では、大気中の酸素によって酸化されます(微量のリンの存在下で - 自然に)。
Р4О6 + 2О2 → Р4О10、このプロセスは化学発光を伴い、白リンの輝きの原因となります。
水とともにトリオキソリン酸 (V) 酸を形成します。
P4O6 + 6H2O → 4H3PO3
構造式によれば、この酸は二塩基性です。
三塩化リンが水と反応すると生成されます。
PCl3 + 3H2O → 3HCl + H3PO3。
遊離状態では、H3PO3 は無色の結晶物質であり、水とアルコールによく溶けます。 これは、金属を塩から還元するかなり強力な還元剤 (亜硝酸よりも強力な還元剤) です。
上から下のグループでは、酸化物の酸性の性質が塩基性の性質に置き換えられます。
酸化ヒ素 (iii) または無水ヒ素 As2O3 は、酸性の性質が優勢な水酸化ヒ素 (iii) – 両性水酸化物に相当します。
As2O3 + 3H2O → 2As (ОH) 3 ↔ 2 H3AsO3。
H3AsO3 – トリオキソヒ酸水素 (iii) は水溶液中にのみ存在します。 この酸の塩は亜ヒ酸塩と呼ばれ、次の反応によって得られます。
As2O3 + 6KOH → 2К3AsО3 + 3H2O
亜ヒ酸カリウム
ヒ素 (iii) 化合物は還元特性を持っており、酸化の結果としてヒ素 (V) 化合物が形成されます。
Sb2O3 – 酸化アンチモン (iii) または無水スチジン酸塩 – 両性酸化物: Sb2O3 + 3H2SO4 → Sb2 (SO4) 3 + 3H2O;
Sb2O3 + 3NaOH → 2NaSbO2 + H2O
Bi2O3 は、酸に溶解してビスマス塩を形成する塩基性酸化物です。 水酸化ビスマス (iii)、Bi (OH) 3 は非常に弱い塩基であるため、ビスマス塩 (iii) は加水分解されてわずかに溶ける塩基性塩を形成します。 Bi (NO3) 2 の加水分解中に、オキソシルが形成されることがよくあります。
Bi (NO3) 2 + H2O → BiОNO3 + 2НNO3。
酸化状態+5
酸化リン (V) – P2O5 (無水リン酸) – 白い砕けやすい粉末で、空気中に広がります。 過剰酸素中でのリンの燃焼中に形成される六方晶系変態は、P4O10 分子から構築されます。 水と激しく反応してメタリン酸からなる複雑な混合物を形成し、沸騰させるとオルトリン酸に加水分解します。 反応には強い加熱が伴います。
共有:
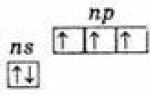
ns 2 np 3.
窒素とその化合物
自然界では、それは遊離の形(空気中の含有量 - 78体積%)、ミネラル(硝石)の形、油中、植物および動物のタンパク質中に存在します。
物理的特性
通常の状態では、N 2 は無色、無臭、無味の気体です。
キップする。 = -195.8℃。
窒素生成:
a) 産業 - 空気液化、
b) 実験室: NH 4 NO 2 ® N 2 + H 2 O。
窒素とその化合物の化学的性質。
窒素分子の化学活性は非常に低いため、 三重共有結合のおかげで、この分子は非常に強力です (E 結合 = 946 kJ/mol)。 しかし、窒素については多くの異なる化合物が知られており、窒素は酸化状態 -3、-2、-1、+1、+2、+3、+4、+5 を示します。
負の酸化状態を持つ窒素化合物。
3
1)NH 3 – アンモニア– 刺激臭のある無色の気体で、容易に液化します。
アンモニアの生成:
a) N 2 + 3H 2 « 2NH 3 (Kat: Fe、Al 2 O 3、K 2 O)
b) 2NH 4 Cl + Ca(OH) 2 = CaCl 2 + 2NH 3 + 2H 2 O
アンモニアの化学的性質:
a) NH 3 + H 2 O « NH 4 OH (最大濃度 = 25%)
b) NH 3 + HCl « NH 4 CI (供給メカニズム: NH 3 + H + = NH 4 +)
c) 酸素の量に応じて燃焼の起こり方が異なります。
4NH 3 + 3O 2 (週) = 2N 2 + 6H 2 O
4NH 3 + 5О 2(g) = 2NO+ 6H 2 O
d) OVR では、アンモニアは常に還元剤です。
3CuO + 2NH 3 = 3Cu + N 2 + 3H 2 O
2) NH 4 OH – 水酸化アンモニウム- 弱塩基、不安定、複雑な化合物 (アンモニア) をよく形成します。
Cu(OH) 2 + 4NH 4 OH = (OH) 2 + 4H 2 O
3) アンモニウム塩:
a) 加水分解による溶液は弱酸性反応を示します。
NH 4 CI + HON « NH 4 OH + HCl (NH 4 + + HON « NH 4 OH + H +)
b) アンモニウム塩の熱分解は、アニオンの性質に応じて異なる進行をします。アニオンが酸化剤の場合、分解反応は不可逆的です。
NH 4 CI « NH 3 + HCl
NH 4 NO 3 = N 2 O + 2H 2 O
4) アミドアンモニア中の H 原子が金属で置換されると形成されます。
2K + 2NH 3 = 2KNH 2 + H 2
5) 窒化物金属と非金属で知られており、その性質に応じて異なる方法で分解されます。
a)Li 3 N + 3H 2 O = 3LiOH + NH 3
Ca 3 N 2 + 6HCl = 3CaCl 2 + 2NH 3
b)Cl 3 N + 6HCl = 3HCIO + NH 3
酸化状態 – 2
N 2 H 4 – ヒドラジン(ジアミド) は無色の液体で、良溶媒ですが、アンモニアよりも不安定です。
ヒドラジンの調製:
2NH 3 + NaCIO = N 2 H 4 + NaCl + H 2 O
ヒドラジンの化学的性質:
N 2 H 4 + H 2 O « + +OH -
H 2 O « 2+ +OH -
b) 燃焼して窒素になる: N 2 H 4 + O 2 = N 2 + 2H 2 O
c) 強力な還元剤: N 2 H 4 + 2H 2 O 2 = N 2 + 4H 2 O
酸化状態 – 1
NH 2 OH – ヒドロキシルアミン、白色の結晶性物質であり、H 2 O 2 とヒドラジン N 2 H 4 の間の中間位置を占めます。
ヒドロキシルアミンの調製:
HNO3 + 6H = NH2OH + 2H2O
ヒドロキシルアミンの化学的性質:
a) 水溶液 – 弱塩基:
NH 2 OH + H 2 O « + +OH -
b) ヒドロキシルアンモニウム塩 (安定) は酸とともに与えられます。
NH 2 OH + HCl = + + CI -
c) 分解(不均化反応):
3NH 2 OH = NH 3 + N 2 + 3H 2 O
d) H 2 O 2 と同様、環境に応じて酸化還元二重性を示します。
わかりました: 2NH 2 OH + 4FeSO 4 + 3H 2 SO 4 = 2Fe 2 (SO 4) 3 + (NH 4) 2 SO 4 + 2H 2 O
復元されました: 2NH 2 OH + I 2 + 2KOH = N 2 + 2KI + 4H 2 O
正の s を持つ最も重要な窒素化合物。 O.
酸化状態+ 3
1) N2O3- 一酸化窒素 (III) または「無水亜硝酸」は、不安定な青緑色の液体です。
a) N 2 O 3 → NO 2 (刺激臭のある茶色のガス) + NO (無色のガス)。
b) 水と不安定な酸を形成します: N 2 O 3 + H 2 O « 2 HNO 2
2) HNO2– 亜硝酸(中濃度):
HNO 2 « H + + NO 2 - (K = 5.1 . 10 -4).
3) 亜硝酸塩– 亜硝酸の塩は、酸化還元反応における他の N +3 化合物と同様に、二重性を示します。
わかりました: KNO 2 + NH 3 = N 2 + H 2 O
復元されました: KNO 2 + H 2 O 2 = KNO 3 + H 2 O
最大酸化状態 + 5
1) N2O5- 一酸化窒素 (V) または「無水硝酸」は無色の結晶性物質です。 水に溶けると酸が生じます。
2) HNO3– 強硝酸: HNO 3 ® H ++ NO 3 - 。
3) 硝酸塩– 硝酸塩:
a) 実験室では、熱分解反応によって N 2 O を得ることができます: NH 4 NO 3 ® N 2 O + H 2 O。
b) 金属硝酸塩は、一連の活性における金属の位置に応じて、異なる方法で分解します。
左のMg:硝酸塩 ® 亜硝酸塩 + O 2
マグネシウム – 銅:硝酸塩 ® 金属酸化物 + NO 2 + O 2
右にCu:硝酸塩®金属 + NO 2 + O 2 。
4) すべての N +5 化合物は強力な酸化剤です。 硝酸と金属の相互作用:
a) HNO 3 から水素を放出する金属はありません。
b)金属に対して垂直に、Al、Zn、Cr、Fe、Pb、Au、Ptが不動態化される。
c) 加熱すると、ほとんどの金属と相互作用し、金属の活性が高く、酸が希薄であればあるほど、N +5 の還元が強くなります。
非活性 まあ: Cu + 4HNO 3 (濃) = Cu (NO 3) 2 + 2NO 2 + 2H 2 O
3Cu + 8HNO 3 (希釈) = 3Cu(NO 3) 2 + 2NO + 4H 2 O
資産。 まあ: 4Ca + 10HNO3(濃) = 4Ca(NO3)2 + N2O + 5H2O
5Ca + 12HNO3 (希釈) = 5Ca(NO3)2 + N2 + 6H2O
4Ca + 9HNO 3 (超希薄) = 4Ca(NO 3) 2 + NH 3 (または NH 4 NO 3) + 3H 2 O
リンおよびその化合物
それは自然界に存在します: a) 鉱物(リン酸塩およびアパタイト)の形で、b) 植物および動物のタンパク質中に、c) 脳組織および骨中に存在します。
物理的特性
アロトロペン:
A) 白リン(P 4) – 四面体構造、有毒、暗闇で光る、二硫化炭素に可溶。 保管中に徐々に赤リンに変化するため、水中で保管されます。
b) 赤リン(P 2 n – ポリマー) – いくつかの構造形態があり、毒性がなく、二硫化炭素に不溶で、保管中に安定で、反応性が低い。
V) 黒リン– ピラミッド構造、層状、グラファイト、半導体に似ています。
リンの入手:
リン鉱石鉱物はコークスと砂で焼成されます。
Ca 3 (PO 4) + 5C + 3 SiO 2 = 3CaSiO 3 +2P +5CO
リンおよびその化合物の化学的性質。
リンの化学活性は、その同素体修飾によって異なります。 主な酸化状態: -3、+1、+3、+5。
1) リンと単体の反応:
修復特性: a)P + O 2 ® P 2 O 3、P 2 O 5;
b)P + CI 2® PCI 3、PCI 5; c) 2P+3S®P2S3
酸化特性: a) 2P + 3H 2 ® 2РН 3、b) 2P + 3Ca ® Ca 3 P 2
2) リンと複合物質の反応:
a) 水との反応が起こらない、
b) 2P + 5H 2 SO 4 (濃) → 2H 3 PO 4 + 5SO 2 + 2H 2 O、
c) P + HNO 3 (濃) → H 3 PO 4 + NO (または NO 2)。
3)最小酸化状態 - 3
A) PH3– ホスフィン、ニンニクのような臭いを持つ有毒ガス、
点灯: 2РH 3 + 4О 2 = Р 2 О 5 + 3H 2 O、
いくつかの酸を加えるとホスホニウム塩が得られます: РH 3 + HI = РH 4 I
b) 金属リン化物– イオン共有結合性化合物
Mg 3 P 2 + 6 H 2 O = Mg(OH) 2 + 2РН 3、
Ca 3 P 2 + 6HCI = CaCl 2 + 2PH 3。
4)酸化状態+ 1
H 3 PO 2 または H[PO 2 H 2 ] – 次亜リン酸、強力。 塩は次亜リン酸塩であり、溶解性が高く、優れた還元剤です。
5)酸化状態+ 3
a) P 2 O 3 – 無水リン、いくつかの修飾 (P 2 O 3) n を持ち、無色の有毒な結晶。
b) H 3 PO 3 または H 2 [PO 3 H] – 亜リン酸、中強度。
c) アルカリ金属 (K 2 [PO 3 H]) にのみ可溶な亜リン酸塩、
PCI 3 + CI 2 = PCI 5、
PCI 3 + O 2 = PCI 3、
PCI3+HCI®N。
6)最大酸化状態 +5
a) P 2 O 5 – 無水リン、白色粉末、修飾 (P 2 O 5) 2 を持ち、強力な水分除去剤: P 2 O 5 + 2H 2 O = 2HPO 3;
b) HPO 3 - メタ、H 4 P 2 O 7 - ピロ、H 3 PO 4 - オルトリン酸、中程度の強度。
c) メタ-、ピロ-、オルト-リン酸塩;
d) ハロゲン化物は非常に活性です:
PCI 5 + 4H 2 O = H 3 PO 4 +5HCI、
RF5 + HF = N.
サブグループの一般的な特徴
7 N、15 P、33 As、51 Sb、83 Bi。 上から下のサブグループでは、金属特性が自然に増加します。これは、化合物内の元素によって示される酸化状態の値およびいくつかの物理的特性と一致します。 P、As、および Sb の同素性により、物理特性を 1 つの表に組み合わせるときに特定の困難が生じます。
表11
主要サブグループである第 5 グループの元素の性質
化学的特性
1. 単純な物質からさまざまな化合物が生成され、異なる酸化還元性質を示します。
a) 修復特性
2P + 3Cl 2 = 2PCl 3 (またはPCl 5);
4As + 5O 2 = 2As 2 O 5;
2Bi + 3Cl2 = 2BiCl3。
b) 酸化特性
2P + 3Ca = Ca 3 P 2 ;
2As + 3Mg = Mg 3 As 2.
2. サブグループ元素の性質に応じて、酸との反応の仕方が異なります。
2P + 5H 2 SO 4 = 2H 3 PO 4 + 5SO 2 + 2H 2 O;
3As + 5HNO 3 + 2H 2 O = 3H 3 AsO 4 + 5NO;
3Sb + 5HNO 3 = 3HSbO 3 + 5NO + H 2 O;
2Sb + 6H 2 SO 4 濃度 = Sb 2 (SO 4) 3 + 3SO 2 + 6H 2 O;
Bi + 4HNO 3 = Bi(NO 3) 3 + NO + 2H 2 O。
ヒ素サブグループの元素は、一連の活動において水素の後に現れることを覚えておく必要があります。
3. 化合物の加水分解はさまざまな方法で起こります。
a) PCl 3 + 3H 2 O = H 3 PO 3 + 3HCl;
BiCl 3 + H 2 O ® BiOCl â + 2HCl。
(SbCl3) (SbOCl)
b) NaNO 2 + H 2 O Û HNO 2 + NaOH;
K 3 PO 4 + H 2 O Û K 2 HPO 4 + KOH;
K 3 AsO 4 + H 2 O Û K 2 HAsO 4 + KOH。
4. 元素の酸塩基特性の変化はさまざまな形で現れます。
表12
第 5 サブグループの元素の最も重要な化合物
5. 化合物の酸化還元能力は、元素の酸化の程度によって異なります。
A) E-3– 還元剤
2NH 3 + 6KМnO 4 + 6KOH = 6K 2 MnO 4 + N 2 + 6H 2 O;
2PH 3 + 4O 2 = P 2 O 5 + 3H 2 O。
酸化剤:
2KNO2 + 4H2S = 3S + N2 + K2S + 4H2O
E+3 2BiCl 3 + 3SnCl 2 + 18KOH = 2Bi + 3K 2 SnO 3 + 12KCl + 9H 2 O。
還元剤:
10KNO 2 +4KМnO 4 +11H 2 SO 4 =10HNO 3 +4MnSO 4 +7K 2 SO 4 +6H 2 O
V) E+5 – 酸化剤
Na 3 SbO 4 + 2NaJ + H 2 SO 4 = Na 3 SbO 3 + J 2 + Na 2 SO 4 + H 2 O。
グループ 6 の要素。 (カルコゲン)
電子シェルの構造: ... ns 2 np 4.
8 O、16 S、34 Se、52 Te、84 Po (放射性)。
酸素とその化合物
地球上で最も一般的な元素: 空気中の 21% (体積比) は、H 2 O、鉱物、有機物質の一部です。
物理的特性
物質の形で存在します。
a) 「酸素」O 2 – 色、味、匂いのない、無毒の気体。 沸騰させてください。 = -183℃; ;
b) 「オゾン」O 3 – 刺激臭のある青いガスで、有毒で、非常に強力な酸化剤です。 沸騰させてください。 = -111.8℃。
化学的特性
1. 酸素が還元剤となる反応は 1 つだけです。
O 2 + 2F 2 = 2OF 2 ()。
2. 他のすべての場合、特に原子状態にある場合、酸素は酸化剤です。
a) 単体の酸化
2H 2 + O 2 = 2H 2 O;
S + O 2 = SO 2;
2Ca + O 2 = 2CaO。
b) 複合物質の酸化
R 2 O 3 +O 2 =R 2 O 5;
2SO 2 + O 2 = 2SO 3;
2PCl 3 + O 2 = 2POCl 3。
c) 複雑な無機物質の燃焼
2H 2 S + O 2 が不足しています = 2S + 2H 2 O;
2H2S+3O2g。 = 2SO 2 + 2H 2 O。
d) 有機物の燃焼
CH 4 + 2O 2 = CO 2 + 2H 2 O;
C 2 H 5 OH + 3O 2 = 2CO 2 + 3H 2 O。
硫黄およびその化合物
自然界ではネイティブな形で見つかります。 鉱物(硫化物、硫酸塩)の形で。 油中。 タンパク質の中で。
物理的特性
硬く、脆く、黄色で、H 2 O には不溶ですが、二硫化炭素とアニリンには可溶です。 同素体: 斜方晶系硫黄 (a-form); 単斜晶系 (b - 硫黄); 最も安定な修飾は a (t° pl. » 113°C) であり、組成 S 8 はこれに起因すると考えられます。
化学的特性
化合物は異なる酸化度を示し、異なる酸化還元能力を持っています。
表13
最も重要な硫黄化合物
1. 硫黄は、複雑な化合物と相互作用して、その酸化状態をさまざまな方法で変化させます。
a) S + 2H 2 SO 4 濃度 = 3SO 2 + 2H 2 O ();
b) S + 6HNO 3 濃度 = H 2 SO 4 + 6NO 2 + 2H 2 O ();
c) 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
不均化反応
2. 接続S-2
A) H2S– 硫化水素、腐った卵の臭いを持つ有毒ガス、強力な還元剤: 2H 2 S + O 2 = 2S + 2H 2 O。
H 2 S + Cl 2 = 2HCl + S。
b) H 2 S 溶液 – 弱酸
H 2 S × N + + HS - (K 1 = 6 × 10 -8)。
c) 塩 - 硫化物。 アルカリ金属およびアルカリ土類金属の塩は溶解性が高く、加水分解します。 p-金属およびd-金属の硫化物は実質的に不溶性です。
G) 硫化物金属の展示 主要自然:
K 2 S + H 2 O Û KHS + KOH;
非金属硫化物の展示 酸性の自然:
SiS 2 + 3H 2 O = H 2 SiO 3 + 2H 2 S。
d) チオソール: O 原子が S に置き換わった通常の塩と同様:
Na 2 S + CS 2 = Na 2 CS 3 – チオ炭酸ナトリウム;
Na 2 CS 3 + 2HCl = 2NaCl + H 2 CS 3
不安定な
e) ポリスルフィド: 硫黄は、過酸化物の酸素と同様に、塩を形成する可能性があります: Na 2 S 溶液 + 'S = Na 2 S n - 多硫化ナトリウム (硫化物架橋 - S - S - S - S - を含む)。
3. S+4接続
a) SO 2 – 刺激臭のある二酸化硫黄であり、有毒です。
b) SO 2 溶液 - 亜硫酸 H 2 SO 3、中強度
H 2 SO 3 Û H + + HSO 3 - (K 1 = 1.3 × 10 -2);
c) 塩 - 亜硫酸塩、よく加水分解します。
Na 2 SO 3 + H 2 O Û NaHSO 3 + NaOH。
d) 酸化還元反応では、これらすべての化合物は二重性を示します。
SO 2 + 2H 2 S = 3S + 2H 2 O;
2SO 2 + O 2 = 2SO 3。
e) 塩化チオニル: SOCl 2
SOCl 2 + 2H 2 O = H 2 SO 3 + 2HCl。
4. S+6接続
A) SO3– 無水硫酸; 同素体の強力な酸化剤。 水と非常に激しく反応する
SO 3 + H 2 O → H 2 SO 4 + 89.1 kJ/mol;
b) H2SO4– 硫酸、無色の油状液体。 強い。
H 2 SO 4 濃度 – 非常に強力な酸化剤; 紙、砂糖、木を焦がす:
C + 2H 2 SO 4 濃度 = CO 2 + 2SO 2 + 2H 2 O。
個別に、金属に対するその挙動は次のとおりです。
常温では多くの金属と相互作用しません(Cr、Fe、Al、Zn などを「不動態化」します)。
レベルが高くなると、Au と Pt を除くほぼすべての金属と反応します。
それは非常に優れた水分除去剤であるため... 水と水和物 H 2 SO 4 × nH 2 O を形成します。
V) 塩: 中 – K 2 SO 4 (硫酸塩);
酸性 – KHSO 4 (硫酸水素塩);
ビトリオール - CuSO 4 × 5H 2 O; ZnSO 4 × 7H 2 O;
ミョウバン – 複塩、結晶水和物
KAl(SO 4) 2 × 12H 2 O; NH 4 Fe(SO 4) 2 × 12H 2 O。
G) 発煙硫酸– SO 3 の H 2 SO 4 溶液、反応は部分的に起こる
2SO3 + H2O = H2S2O7 ピロ硫酸.
d) 塩化スルフリル SO2Cl2
SO 2 Cl 2 + 2H 2 O = H 2 SO 4 + 2HCl。
e) ペルオキソ硫酸– 過酸化物橋を含む
H 2 SO 5 – ペルオキソモノ硫黄、
H 2 S 2 O 8 – ペルオキソ二硫黄;
強力な酸化剤。
そして) チオ硫酸塩– さまざまな酸化状態の硫黄が含まれています: S +6 および S -2。 S-2 の存在により、この化合物は強力な還元剤になります。
Na 2 S 2 O 3 + Br 2 + H 2 O = 2HBr + S + Na 2 SO 4。
対応する酸 H 2 S 2 O 3 (チオ硫酸) は不安定です。
Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + H 2 S 2 O 3。
グループ 7a の元素。 (ハロゲン )
電子シェルの構造: ... ns 2 np 5.
9 F、17 Cl、35 Br、53 J、85 At (放射性)。 遊離状態では、それらは二原子分子の形で存在します。
物理的特性
有毒で刺激臭があります。 F 2 – 淡黄色のガス、沸点。 = -188.2℃;
Cl 2 – 黄緑色のガス。 沸騰させてください。 = -34.1℃;
Br 2 – 赤い液体。 沸騰させてください。 = 59.2℃;
J 2 – 紫色の結晶。 沸騰させてください。 = +185.5℃。
化学的特性
1) 最も活性なのは F 2 で、その大気中ではガラスや水も燃えます。
2F 2 + SiO 2 = SiF 4 + O 2;
2F 2 + 2H 2 O = 4HF + O 2。
2) 上流のハロゲン (より強力な酸化剤として) が、さまざまな化合物の下流のハロゲンを置き換えます。
F 2 + 2KCl (KBr、KJ) = 2KF + Cl 2 (Br 2、J 2)。
3) ハロゲンが水やアルカリ溶液に溶解すると、不均化反応が起こります。 温度に応じて、さまざまな反応生成物が得られます。
Cl 2 + H 2 O = HCl + HClO;
Cl 2 + 2NaOH = NaCl + NaClO;
4) ハロゲン化水素– これらはすべて無色の気体です (HF は水素結合により、H x F x 会合体を形成します)。
HF – HCl – HBr – HJ の系列では、結合強度が低下し、還元特性が増加します。
MnO 2 + 4HCl = Cl 2 + MnCl 2 + 2H 2 O ()。
5) 水に溶解すると強酸が得られます。 HJ が最も強力です (弱フッ化水素酸を除く)。
H 2 F 2 Û H + + HF 2 -)
6) ハロゲン化物元素には異なる酸塩基の性質があり、それが明らかになります。
a) 加水分解反応において
AlCl 3 + H 2 O Û AlOHCl 2 + HCl;
PBr 3 + 3H 2 O = H 3 PO 3 + 3HBr。
b) 錯体形成反応において
2NaF + SiF 4 ® Na 2 ;
配位子の数については F - ; Cl - ; Br - ; J - 複合体の安定性が低下します。
7) より高い酸化状態のハロゲン
a) 酸化物: Cl 2 O; (ClO2)2; (ClO 3 ) 2; Cl 2 O 7;
b) 酸: HClO; HClO2; HClO3; HClO4;
多くの酸 ® では強度が増加し、同じシリーズの酸とその塩では酸化特性が減少します。
c) 酸とその塩は加熱すると分解します。
d) ハロゲン間の化合物: それらの多くは知られています。 組成は、周期表の元素の位置に対応します (電気陰性元素は式の最後に表示されます)。
ClF、BrF、JF; ClF 3、JF 3; ClF5、ClOF3; BrF7、JO3F等;
本質的に酸性です: JF 7 + 4H 2 O = 7HF + HJO 4;
ClO 3 F + 2NaOH = NaClO 4 + NaF + H 2 O。
資料を統合するための質問:
1. ヒ素が濃硝酸と反応すると、どのような物質が形成されますか? a)-s(NO3)3? b)H 3 AsO 4? c) 2 O 3 として?
2.濃酸と反応して遊離塩素を放出する物質は何ですか – a)CaCl 2? b)MnO2? c) CrC1 3 ?
講義No.16
トピック: 2.1.3. 「グループ V の主要サブグループ。 窒素化合物」
モチベーション。
空気には体積で約 78% の窒素が含まれています。
窒素は、アミノ酸、タンパク質、硝酸塩などの有機および無機化合物の一部です。
窒素は、アンモニア、硝酸、窒素肥料を製造するための原料です。
アンモニアからは硝酸や水酸化アンモニウムなどが得られます。 アンモニアは医療に広く使用されています。
硝酸は医薬品に使用される主要な試薬の 1 つです。 分析。 酸を扱うときは注意が必要です。 医学では、いぼを除去するために計算された濃度で使用されます。
このトピックの知識は、化学および特殊分野を勉強するために必要です。
1. 講義中、学生は V 族元素である窒素とその化合物、アンモニア、アンモニウム塩、窒素酸化物、亜硝酸とその塩、硝酸とその塩の性質、作業時の安全上の注意について理解する必要があります。硝酸と一緒に。
2. レッスン中に次の知識を確実に吸収してください: - 名前の付いた PSHE での位置に応じた、主要サブグループのグループ V の元素の特徴。 DI. メンデレーエフ。
窒素の物理的および化学的性質。
硝酸の特別な性質。
UPS: トピック: 「無機化合物のクラス」、
「周期法則と化学元素の周期系にちなんで名付けられました。 DI. メンデレーエフ」、「化学結合」。
「酸化還元反応」
「電離理論」。
分析化学 t.「陰イオン」
t.「カッチ。 アニオンに対する反応 I ~ III gr.」
t. 「酸塩基滴定の方法」。
コート「アミンズ」
T. 「アゾ化合物およびジアゾ化合物」
学生の知識を最新の状態に保つための質問。
1. メインサブグループのグループ V の要素をリストします。
2. これらの元素の最高価数を決定するにはどうすればよいですか?
3. 窒素の最高価数が 3 なのはなぜですか?
4. 窒素の最高および最低の酸化状態は何ですか?
5. どの化合物の窒素原子は (- 3) の酸化状態を示しますか?
6. 窒素はどのような酸化物を形成しますか?
トピックをマスターした結果の要件:
薬剤師が持っていなければならないのは、 一般的な能力、能力を含む(基礎訓練中):
OK 1. 将来の職業の本質と社会的意義を理解し、継続的な関心を示します。
OK 2. 独自のアクティビティを整理し、標準的な方法と専門的なタスクを実行する方法を選択し、その有効性と品質を評価します。
OK 3. 標準およびで決定を行います。 規格外の
状況を把握し、それらに対して責任を負います。 。
OK 4.検索してください。 専門的な業務の効果的な遂行、専門的および個人的な能力開発に必要な情報の使用。
OK 5. 専門的な活動に情報通信技術を使用します。
OK 6. チームで協力して働き、効果的にコミュニケーションする
同僚、経営陣、消費者と。
OK 8. 専門家と専門家のタスクを独立して決定します。
自己啓発、意識的に自己教育に取り組む
スキルの向上を計画します。
薬剤師が持っていなければならないのは、 プロ
コンピテンシー、職業上の活動の主な種類に対応します (基礎トレーニング):
パソコン1.6。 衛生管理、労働保護、安全および火災安全に関する規則を遵守してください。
パソコン2.3。 必要な種類の薬局内管理を備えている
薬。
パソコン2.4。 衛生管理、労働保護、安全および火災安全に関する規則を遵守してください。
講義計画.
1. D.I.メンデレーエフの周期系の主要サブグループのV族元素の一般的特徴。
2. 窒素の生物学的役割(独立)
3.窒素。 窒素の周期表上の位置に基づく、原子構造、酸化状態、物理的性質、自然界の分布、製造方法、化学的性質の理論の観点から見た窒素の特徴。 最も重要な窒素化合物。
4. アンモニア、その製造方法、物理的および化学的性質。
5. アンモニウム塩、製造方法、特性。 アンモニウムカチオンに対する定性的反応。
6. 窒素およびその化合物の医療および国民経済への応用。 (自分で)。
7. 窒素酸化物。 亜硝酸。 亜硝酸塩。
亜硝酸イオンに対する定性反応。
8. 硝酸、製造方法、物理的および化学的特性、操作中の安全上の注意事項。 硝酸塩。
9.硝酸陰イオンに対する定性反応
I. 主要なサブグループのグループ V の元素の一般的特徴。
PS グループ V の元素のうち、医学的に重要な主なグループは、窒素、リン、ヒ素、アンチモン、ビスマスなどの主要グループです。
これらの元素の原子の外層には5つの電子があるため、電子を追加する能力は、VI族およびVII族の対応する元素よりも顕著ではありません。 一方、主部分群 V gr. の元素は次のようになります。 VI 族および VII 族の元素よりも電子を放出しやすいため、それらの酸素化合物はより安定です。 その結果、サブグループの元素は正と負の両方の酸化状態を示します。
このサブグループの元素の最も高い正の酸化状態
EOが比較的低いため、これらの元素と水素の結合は、VI族およびVII族の元素の水素との結合よりも極性が低くなります。 その結果、問題の元素の水素化合物は分離されません。
水溶液中では水素イオンであるため、酸性の性質を持ちません。
結論:
1. PS V 族元素の原子の外層には 5 つの電子があります。
2. 電子を追加する能力は、VI 族および VII 族の対応する元素の能力ほど顕著ではありません。
3. 主要サブグループ V gr の要素。 VI 族および VII 族の元素よりも容易に電子を放棄します。
4. このサブグループの元素の最も高い正の酸化状態
+ 5 に等しく、負の - 3 に相当します。
窒素サブグループは、窒素、リン、ヒ素、アンチモン、ビスマスの 5 つの元素で構成されます。 これらは、D.I. メンデレーエフの周期系の V 族の p 元素です。
外側のエネルギー レベルでは、これらの元素の原子には 5 つの電子が含まれており、ns2np3 配置を持ち、次のように分布しています。

したがって、これらの元素の最高の酸化状態は +5 で、最低は -3 であり、+3 も典型的です。
外側準位に 3 つの不対電子が存在するということは、非励起状態では元素の原子の価数が 3 であることを示しています。窒素原子の外側準位は、2s と 2p の 2 つのサブ準位のみで構成されています。 このサブグループの残りの元素の原子には、外側のエネルギー準位に d サブ準位の空セルがあります。 その結果、外側準位の s 電子の 1 つが励起されると、同じ準位の d 副準位に移動し、5 つの不対電子が形成されます。

リンの外側の電子殻(励起されていない原子)

励起されたリン原子の外側の電子殻。
したがって、リン、ヒ素、アンチモン、ビスマスは励起状態では 5 個の不対電子を持ち、この状態での価数は 5 になります。
窒素原子では、第 2 準位に d 副準位が存在しないため、この方法で電子を励起することは不可能です。 したがって、窒素は 5 価になることはできませんが、孤立電子対 2s2 によるドナー - アクセプター機構によって 4 番目の共有結合を形成することができます。 窒素原子については別の処理も可能です。 2 つの 2s 電子のうち 1 つが除去されると、窒素は 1 価の 4 価イオン N+ に変化します。

窒素からビスマスまで、原子半径は増加し、イオン化ポテンシャルは減少します。 中性原子の還元特性は N から Bi に増加し、酸化特性は弱まります (表 21 を参照)。
水素、窒素、リン、ヒ素は極性化合物 RH3 を形成し、-3 の負の酸化状態を示します。 RH3 分子はピラミッド型の形状をしています。 これらの化合物では、元素と水素の結合は、酸素サブグループ、特にハロゲンサブグループの元素の対応する化合物よりも強力です。 したがって、水溶液中の窒素亜族元素の水素化合物は水素イオンを形成しません。

酸素により、窒素サブグループの元素は一般式 R2O3 および R2O5 の酸化物を形成します。 酸化物は酸 HRO2 および HRO3 (窒素を除くオルト酸 H3RO4) に対応します。 サブグループ内では、酸化物の性質は次のように変化します。 N2O3 - 酸性酸化物。 Р4О6 - 弱酸性酸化物。 As2O3 は、主に酸性の特性を持つ両性酸化物です。 Sb2O3 は、塩基性の性質が優勢な両性酸化物です。 Bi2O3 が主な酸化物です。 したがって、組成 R2O3 および R2O5 の酸化物の酸性特性は、元素の原子番号が増加するにつれて減少します。
表からもわかるように。 図21に示すように、窒素からビスマスまでのサブグループ内では、非金属特性が減少し、金属特性が増加する。 アンチモンではこれらの特性が同等に表現され、ビスマスでは金属的特性が優勢であり、窒素では非金属的特性が優勢です。 リン、ヒ素、アンチモンはいくつかの同素体化合物を形成します。
窒素。
レシート
実験室では、亜硝酸アンモニウムの分解反応によって得られます。
この反応は発熱性であり、80 kcal (335 kJ) を放出するため、反応が起こっている間容器を冷却する必要があります (ただし、反応を開始するには亜硝酸アンモニウムを加熱する必要があります)。
実際には、この反応は加熱した飽和硫酸アンモニウム溶液に飽和亜硝酸ナトリウム溶液を滴下することにより行われ、交換反応により生成した亜硝酸アンモニウムは瞬時に分解する。
この場合に放出されるガスはアンモニア、窒素酸化物 (I) および酸素で汚染されており、硫酸、硫酸鉄 (II) の溶液、および熱銅の上を連続的に通過させることによって精製されます。 次いで、窒素を乾燥させる。
実験室で窒素を生成するもう 1 つの方法は、重クロム酸カリウムと硫酸アンモニウムの混合物 (重量比 2:1) を加熱することです。 反応は次の方程式に従って進行します。
最も純粋な窒素は、金属アジ化物の分解によって得られます。
いわゆる「空気」または「大気」窒素、つまり窒素と希ガスの混合物は、空気とホットコークスを反応させることによって得られ、いわゆる「発電機」または「空気」ガス - 原料が生成されます。化学合成および燃料用。 必要に応じて、一酸化炭素を吸収することにより窒素を分離することができます。
分子状窒素は、液体空気の分別蒸留によって工業的に製造されます。 この方法は「大気中の窒素」を取得するためにも使用できます。 吸着および膜ガス分離法を使用する窒素設備およびステーションも広く使用されています。
実験室での方法の 1 つは、約 700 °C の温度で酸化銅 (II) 上にアンモニアを通過させることです。
アンモニアは飽和溶液から加熱することによって取り出されます。 CuO の量は計算値の 2 倍です。 使用直前に、窒素は銅とその酸化物 (II) (同じく約 700 °C) を通過させることによって酸素とアンモニアから精製され、その後濃硫酸と乾燥アルカリで乾燥されます。 このプロセスは非常に時間がかかりますが、それだけの価値はあります。得られるガスは非常にきれいです。
「」というテーマに関する公開授業の概要のスキームVグループのメインサブグループ」
レッスンタイプ : 新しい教材を学ぶレッスン
レッスンの目的 : 新しい知識の吸収と、以前に習得したスキルと能力の応用の組織化
タスク:
教育的 :既存の知識に基づいて新しい知識の吸収を促進します。 スキルと能力の形成電子層内の電子の数を示す窒素原子の構造図を作成する; 窒素の特徴的な価数と酸化状態を決定します。酸化の観点から窒素の化学的性質を考慮する- 原子の還元能力.
発達 : 独立した思考、記憶、比較能力の発達を促進します。
教育的 :思考プロセスを実行する際の学生の責任と誠実さ、批評性と自己批判、活動性と注意力を保証する個人的な資質の形成のための条件を作成します。
メソッド : 解説・イラスト、生殖、部分検索
方法論 : マルチレベルで差別化されたトレーニングの方法論類似点を見つけるためのテクニック.
教材 :
参考資料:
元素の周期表。
電気陰性度表。
レッスン用の教材
教科書
プレゼンテーション
配布資料
技術的手段 :
マルチメディア
レッスンステージ。 レッスンの各段階のタスク
学生の活動
私.整理時間
私はあなたが仕事で成功できるように準備しました。
自制心を促進する
生徒さんやレッスンのゲストにご挨拶。 欠席者には印をつけておきます。 レッスンへの準備ができているか確認します。
ゲストや講師へのご挨拶、レッスンの準備
Ⅱ.既存の知識の更新 1. レッスンの本題にご紹介します。
動画の背景には、名前は触れずに、過去の経験(博物学、中学2年)に基づいた物質の説明があります。
彼らは見て、聞きます。 ビデオの終了後にレッスンのトピックを提案します
2. レッスンの主な目的を決定します
要素を特徴づける方法を学ばなければなりませんVメインサブグループグループ
窒素の基本価数を知っておく必要がある
窒素の基本的な酸化状態を知っておく必要がある
窒素の化学的および物理的性質を知っておく必要がある
レッスンのトピックを録音します。 聞いて分析する
3.差別化された目標の選択
最初のゴール – 黄色では、学んだ知識の伝達のみが必要です。
2点目 論理的に考える力が必要になります。 授業で学んだ事実を説明する能力。
3点目 化学だけでなく、あらゆる知識を総動員する必要がある
黄色のターゲット (ベースライン) - A
グリーンターゲット(上級) - B
レッドターゲット(上級) - C
主要なサブグループの元素を特徴づけることができ、窒素の基本的な価数と酸化状態を知ることができます。 窒素の物理的および化学的性質を理解します。
A + 変化を説明できる
メイン要素のプロパティ
サブグループ。 窒素の酸化還元特性を説明できる。
B + 性質を推測できるようになる
窒素、結論の理由を説明し、知識を実際に適用します。
Ⅲ.新しい教材の学習
私は周期システム D.I. を使用して作業するスキルを開発しています。 メンデレーエフ、論理的思考力、比較する能力。
注意力と正確さを養います
1.教科書と参考資料(元素周期表)を使って学習します。 質問に対する答え。 質問は画面に表示され、読み上げられます。 回答は確認のために画面に複製されます。
質問に答えてノートに書きます。 1. どのような要素が含まれるかVグループのメインサブグループ?
2. グループ内の要素のプロパティは、上から下に向かって相互にどのように変化するのでしょうか?
ノートに書くこと。 質問に答えてください: 1. 原子の外側の電子殻の構造は何ですか?Vグループのメインサブグループ? 学生は黒板で答えます。
2. 要素を他に何と呼ぶことができますか?Vメインサブグループのグループ?
3. グループ内の元素の核電荷が窒素からビスマスに増加するのはなぜですか?
4. グループ内の原子の半径が窒素からビスマスまで増加するのはなぜですか?
ノートに書くこと。 質問に答えてください: 1. このグループのすべての要素を統合するものは何ですか? 学生は黒板で答えます。
2. グループ内の元素の原子量が窒素からビスマスに増加するのはなぜですか?
3. 窒素からビスマスまでのグループの元素の金属的性質が増加するのはなぜですか?
4. グループ内の元素の電気陰性度が窒素からビスマスに減少するのはなぜですか?
注意力、認知活動、好奇心の活性化。 教科間コミュニケーション
窒素の発見とその名前に関する短いエッセイ
ノートに記録して、聞いてください。
ノートに記録して、聞いてください。 窒素の価数と酸化状態の問題への答え
ノートに記録して、聞いてください。 窒素の名前と性質の不一致への対応
認知的関心の活性化。教科書を使って学習するスキルを身につけています。個々の観察力の発達のための最小限の条件を作り出し、発達を促進することにより、生徒が自主的に必要な情報を取得する能力
2. 外側電子殻構造の図記録に基づく窒素の価数と酸化状態の決定
ノートに書くこと
取締役会で働きます。 ノートに書くこと
教科書を使った作業。 説明とノートへの記録
3.対象物質の一次結合
どのような要素が含まれているのかVグループについてはどうですか?
窒素の基本価数は何ですか?
窒素の主な酸化状態は何ですか?
エントリーの意味は何でしょうか?N -3 ?
エントリーの意味は何でしょうか?N +3 ?
エントリーの意味は何でしょうか?N 0 ?
窒素が酸化状態を示す化合物を合成する
記憶力の発達のための条件を作り、発達を促進します論理的思考スキル、比較する能力、結論を導き出し、それを正当化する能力。
窒素単体の分子の構造。
合唱の応答が許可される
ノートに書くこと
ノートに書くこと
ノートに書くこと
記憶力の発達のための条件を作り、発達を促進します論理的思考スキル、比較する能力、結論を導き出し、それを正当化する能力。
窒素の化学的性質
窒素は酸化剤です。
窒素還元剤
ノートに書くこと
ノートに書くこと
窒素は酸化剤としてどの元素と反応しますか?
ノートに書くこと
窒素がどのような化学反応を起こすか考えてみてください。
記憶力の発達のための条件を作り(自然史の授業、中学2年生の教材の繰り返し)、記憶力の発達を促進します。論理的思考スキル、比較し、結論を導き出し、それを正当化する能力。
窒素の物性
ノートに書くこと。 窒素の物性に関する質問に対する、これまでの経験と経験に基づいた回答
ノートに書くこと
ノートに書くこと
Ⅳ.材料を確保する
私は、記憶力の発達、生徒の責任と誠実さ、批評性と自己批判を保証する個人的な資質の形成のための条件を作成します。 開発に貢献します論理的思考力、比較する能力。
窒素は化学反応においてどのように現れますか?
窒素は酸化剤として何と反応しますか?
窒素は還元剤として何と反応しますか?
黄色のチームの答えを手伝ってください
空気を溶液として考えると、窒素は空気中でどのような役割を果たしますか?
V。 要約する
別れの言葉。 ロックにおける自分の仕事を自己評価するための条件を作り出す
同じ色のトークンを 3 つ集めたのは誰ですか?
トークンを 3 つ以上集めたのは誰ですか?
誰が違う色のトークンを持っていますか?
トークンの裏に姓を書いて、クラスの終わりに提出してください。
レッスンのベルが鳴った後、トークンを渡します。
レッスンのベルが鳴った後、トークンを渡します。
VI。宿題
生徒の認知活動と記憶力の発達のための条件を作ります
建物が画面に表示されます
レコードD/Z
§ 15 52 ページ No. 1
2 つの質問に書面で答えてください。
このトピックから何を学んだでしょうか?
何を知りたいですか(授業中に答えられなかった質問は何ですか)?
レコードD/Z
§15 p.52 No.1 レッスンのテーマについて 5 文字のクロスワード パズルを作成する
レコードD/Z
§15№1
窒素変換反応を 5 つ書き出す
Ⅶ。反射
レッスン後のクラスの感情の激しさを判断する
木「秋・春」
ツリー装飾「秋~春」
ツリー装飾「秋~春」