Chemie prvků hlavní podskupiny 5. skupiny. Obecná charakteristika prvků skupiny V A
Mezi prvky skupiny V patří dusík 7N, fosfor 15P, Arsen 33As, antimon 51Sb a vizmut 83Bi. Analogicky s halogeny a chalkogeny byl pro ně navržen společný název: „pniktogeny“ (přeloženo z řečtiny - dusivé, s nepříjemným zápachem, což se týká zejména vodíkových sloučenin těchto prvků).
V základním stavu mají atomy prvků skupiny V A elektronovou konfiguraci vnější vrstvy ns2nр3 se třemi nepárovými p-elektrony. V řadě N – P – As – Sb – Vi se zvětšují velikosti atomů a klesají ionizační energie, což vede ke zvýšení kovových vlastností: ve volné formě jsou dusík a fosfor typické nekovy, arsen a antimon jsou metaloidy, vizmut je kov. S rostoucím poloměrem se také zvyšují koordinační čísla (CN) atomů. Dusík je charakterizován koordinačními čísly 1-4, fosfor má obvykle koordinační číslo 4, ale ve sloučeninách s halogeny může koordinační číslo dosáhnout 6, arsen a antimon vykazují koordinační číslo 4,6 a vizmut má koordinační číslo 7 , 8, 9.
Díky svému malému poloměru a vysoké elektronegativitě se dusík liší od ostatních prvků své podskupiny. Jeho nedostatek energeticky dostupné prázdné d-podúrovně vede k tomu, že atom dusíku může tvořit maximálně čtyři kovalentní vazby, včetně jedné vazby prostřednictvím mechanismu donor-akceptor.
V důsledku zvětšení atomového poloměru a zmenšení překryvu atomových p-orbitalů klesá síla jednoduchých σ vazeb v řadě N-P-As-Sb-Bi. Nižší síla vazby N-N ve srovnání s vazbou P-P je způsobena malou velikostí atomů dusíku a z toho vyplývajícím silným odpuzováním elektronů. Síla násobných vazeb se naopak s rostoucí velikostí atomových orbitalů snižuje a v důsledku toho slábne jejich překryv s typem π. Vícenásobné (trojité) vazby pro dusík jsou tedy nejsilnější. Pro fosfor a arsen je tvorba jednoduchých vazeb energeticky výhodnější.
Prvky skupiny V A vykazují různé oxidační stavy. Dusík je charakterizován celým spektrem - od -3 do +5 (-3, -2, -1, +1, +2, +3, +4, +5). Pro fosfor jsou negativní oxidační stavy méně charakteristické než pro dusík. Současně se zvyšuje stabilita sloučenin s vysokým stupněm oxidace, což je spojeno se snížením elektronegativity atomu fosforu, snížením ionizační energie a zvýšením pevnosti vazby. Arsen a antimon ve sloučeninách mají oxidační stavy -3, +3 a +5 a pro sloučeniny vizmutu s oxidačním stavem +3 jsou stabilní.
Prvky skupiny V A v oxidačním stavu +3 si uchovávají nesdílený elektronový pár, který určuje jejich stechiometrii a donorové vlastnosti.
Vlivem kombinovaného působení různých faktorů (zvětšení atomového poloměru, snížení překryvu pπ-pπ, zvýšení stupně stínění vnějších elektronů) se stabilita a oxidační schopnost sloučenin fosforu na následujících prvcích podskupiny nemění. monotónně (sekundární periodicita) - nejvyšší oxidační stupeň je nejstabilnější u fosforu a antimonu, zatímco sloučeniny arsenu a zejména vizmutu s oxidačním stavem +5 jsou často nestabilní nebo vůbec neexistují. Sloučeniny vizmutu (V) jsou silná oxidační činidla.
U kyslíkatých sloučenin fosforu a v menší míře i u následujících prvků skupiny dochází k pπ-dπ - překrytí, které zvyšuje násobnost vazby E-O a zvyšuje její energii. Sloučeniny fosforu proto prakticky nevykazují oxidační vlastnosti, na rozdíl od podobných sloučenin dusíku.
4.2 Být v přírodě
Ve formě jednoduché látky – dusíku N2 – se v přírodě vyskytuje pouze dusík (jeho obsah ve vzduchu je přibližně 78 %). Obsah dusíku v zemské kůře je 2,5 · 10-3 hm.%. Z přírodních minerálů má průmyslový význam dusičnan chilský (NaNO3) a draselný (KNO3).
Fosfor se vyskytuje ve formě fosforečnanů, jeho obsah v zemské kůře je 0,1 hm. Nejběžnějšími minerály jsou apatity - hydroxoapatit Ca5 (PO4) 3OH, fluorapatit Ca5 (PO4) 2F a také fosfority Ca3 (PO4) 2.
Arsen (1,5 10-4 hm.%), Antimon (2 10-5 hm.%), Bismut (5 10-6 hm.%) Vyskytuje se především ve formě sulfidů - orpiment As2S3, stibnit nebo stibium lesk Sb2S3, vizmut lesk Bi2S3, arsenopyrit FeAsS, tetradymit Bi2Te2S, stejně jako sloučeniny kyslíku, například boronit FeAsO4 2H2O, vizmut okr Bi2O3 atd.
4.3 Fyzikální vlastnosti a alotropie
Za normálních podmínek je dusík N2 bezbarvý plyn bez zápachu a chuti, rozpustný ve vodě (2,3 ml / 100 g H2O při 0 °C). Silná intramolekulární vazba, malá velikost a nepolarita molekuly N2 jsou důvody slabé intermolekulární interakce, proto má dusík nízké teploty tání a varu (-2100C, resp. -1960C).
Všechny ostatní prvky skupiny V A jsou při teplotě místnosti pevné látky s několika alotropními modifikacemi.
Pro fosfor jsou známy tři alotropní modifikace: bílá, červená a černá.
Bílý fosfor je měkká krystalická látka podobná vosku s nepříjemným česnekovým zápachem. Bílý fosfor je velmi jedovatý, chemicky aktivní a na vzduchu se snadno samovolně vznítí, proto je uložen pod vrstvou vody, ve které je prakticky nerozpustný. Dobře se rozpouští v sirouhlíku CS2 (pokud tímto roztokem uděláte nápis na zeď nebo navlhčíte knot svíčky, tak po chvíli díky odpařování sirouhlíku zviditelní neviditelný nápis na zdi, a svíčka se sama utěsní). Bílý fosfor má molekulární mřížku, v jejíchž uzlech jsou tetraedrické molekuly P4. Bílý fosfor je prudký jed, při zahřátí na 320°C bez přístupu vzduchu se mění na červený fosfor.
Červený fosfor na rozdíl od bílého fosforu není jedovatý, nerozpouští se v sirouhlíku a ve tmě nesvítí. Červený fosfor se skládá ze skupin P8 a P9, spojených můstky dvou atomů fosforu. Červený fosfor je méně aktivní.
Černý fosfor je nejstabilnější modifikací, vzniká z bílého fosforu zahřátím na 220 °C a při velmi vysokém tlaku (1200 atm.). Svým vzhledem připomíná grafit a je to polovodič.
Arsen, antimon a vizmut, stejně jako fosfor, existují ve formě několika modifikací. Žlutý arsen As4 má podobnou strukturu jako bílý fosfor. Během skladování se samovolně přemění na stabilnější šestiúhelníkovou formu, která svou strukturou připomíná černý fosfor. Je také nejstabilnější pro antimon a vizmut.
V řadě od fosforu k bismutu se zvyšují koordinační čísla, objevuje se kovový lesk, snižuje se křehkost a zvyšuje se elektrická vodivost.
4.4 Metody získávání jednoduchých látek
V průmyslu se dusík získává frakcionací zkapalněného vzduchu. K tomu se vzduch pod vysokým tlakem přemění na kapalné skupenství a následně se dusík oddělí odpařováním od lehčí složky – kyslíku (pro dusík bod varu = -195,8°C, pro kyslík bod varu = -183°C ).
V laboratoři se dusík získává tepelným rozkladem dusitanu amonného, azidu lithného nebo zahříváním směsi roztoků dusitanu sodného a chloridu amonného:
NH4NO2 -> N2 + 2H20;
2LiN3 -> 3 N2 + 2Li;
NaNO2 + NH4Сl → N2 + 2H2O + NaСl (dusík, který vzniká v důsledku této reakce, může být kontaminován nečistotami kyseliny dusičné a oxidu dusnatého, k jejichž odstranění se plyn vede přes okyselený roztok K2Сr2О7).
Fosfor se průmyslově vyrábí kalcinací směsi drcených fosforitů nebo apatitu s pískem a uhlím v elektrických pecích při teplotě 15000C bez přístupu vzduchu:
Ca3 (PO4) 2 + 3Si02 + 5C -> 3CaSi03 + 2P + 5CO.
Fosfor se uvolňuje jako pára, která kondenzuje v přijímači pod vodou jako bílý fosfor.
Kromě fosfátů je možné redukovat například kyselinu metafosfátovou.
Arsen, antimon a vizmut se získávají pražením sulfidových rud s následnou redukcí oxidu koksem:
2 E2S3 + 9 O2 -> 6 SO2 + 2 E2O3;
2 E2O3 + 3 C → 2 E + 3 CO.
4.5 Chemické vlastnosti jednoduchých sloučenin
Interakce s jednoduchými látkami:
Molekulární dusík má velmi nízkou reaktivitu, což je způsobeno přítomností trojné vazby v molekule N2 a také nepolaritou molekuly. Při pokojové teplotě reaguje dusík pouze s lithiem a při zahřívání s mnoha kovy, například při 300 °C:
3Mg + N2 → Mg3N2
nitrid hořečnatý
Při teplotě elektrického oblouku (asi 3000°C) interaguje dusík s kyslíkem: N2 + O2 → 2NO.
Při teplotě ≈ 450 °C, tlaku 30 MPa a v přítomnosti katalyzátoru (Fe nebo Al2O3) reaguje dusík s vodíkem za vzniku amoniaku:
N2 + 3H2 -> 2NH3.
Reaktivita P, As, Sb, Vi je vyšší než u dusíku. Fosfor při spalování na vzduchu tvoří fosfátový anhydrid P2O5 (s nedostatkem kyslíku - P4O6):
4P + 5O2 → 2P2O5 – oxid fosforečný (V).
As, Sb, Vi se oxidují na trioxid E2O3.
Reakce s halogeny také probíhá intenzivně:
2E + 3Cl2 -> 2ECl3.
V přebytku chloru, fosforu a antimonu tvoří ECI5 pentachlorid.
V důsledku zahřívání s kovy v inertní atmosféře tvoří P, As, Sb, Vi fosfidy, arsenidy, antimonidy a vizmutidy (stechiometrické a nestechiometrické), například:
3Ca + 2P → Ca3P2 – fosfid vápenatý.
4.6 Sloučeniny vodíku prvků skupiny V A
Oxidační stav -3
Všechny prvky skupiny V A tvoří s vodíkem sloučeniny EN3, ale jejich stabilita se liší. Stibin SbH3 a zejména bismutin BiH3 jsou velmi nestabilní. Při pokojové teplotě jsou hydridy prvků skupiny V A bezbarvé plyny s charakteristickým štiplavým zápachem. Molekuly EN3 mají tvar trigonální pyramidy.
V řadě NH3 – РH3 – AsH3 – SbH3 – BiH3 se délka vazby E-H zvětšuje s rostoucím poloměrem atomu E. Zároveň se snižuje překryv orbitalů, což vede ke snížení síly E-H vazby a stability molekul EN3. Reakce tvorby hydridu je exotermická pouze pro amoniak, ale i ten se rozkládá již při teplotě 4000C. BiH3 při teplotě 250C existuje jen několik minut.
Vazba N-H je velmi polární, což se vysvětluje vysokou elektronegativitou dusíku, stejně jako velkým podílem atomových orbitalů dusíku na molekulárních orbitalech amoniaku a velkým celkovým dipólovým momentem. Snížení donorových vlastností nevazebného elektronového páru vede k tomu, že schopnost tvorby iontu EN4+ pro fosfin je mnohem menší a pro arsin prakticky neexistuje.
Teploty tání a varu v řadě NH3 – РH3 – АsH3 – SbH3 se mění nemonotónně. Vysoké teploty fázových přechodů NH3 spojené s přítomností vodíkových vazeb v případě jiných hydridů chybí. Zvýšení teplot tání a varu během přechodu z pH3 na SbH3 je spojeno se zvýšenou intermolekulární interakcí.
Extrakce: Interakcí jednoduchých látek v průmyslu se reakcí získává pouze amoniak NH3:
N2 + 3H2 -> 2NH3.
Průmyslovou syntézu amoniaku zavedl německý chemik F. Haber a v roce 1918 za to obdržel Nobelovu cenu. Reakce se provádí při teplotě 400 až 500 °C a za zvýšeného tlaku (od 10 do 300 atm, v závislosti na zařízení). Pro urychlení reakce se přidává katalyzátor - železná houba s přídavkem oxidů draslíku, vápníku, hořčíku, křemíku.
V laboratoři se amoniak vyrábí zahříváním podle reakce:
2NH4Cl + Ca (OH)2 -> CaCl2 + 2NH3 + 2H2O.
Fosfin pH3 (čirý plyn s vůní shnilých ryb) se obvykle získává reakcemi:
4P + 3NaOH + 3H20 -> PH3 + 3NaH2P02;
Ca3P2 + 5HCl -> 3CaCl2 + 2PH3.
Arsenhydrid neboli Arsinoe AsH3 (čirý, velmi jedovatý plyn s česnekovým zápachem) vzniká redukcí sloučenin arsenu:
As2O3 + 6Zn + 6H2SO4 → 2AsH3 + 6ZnSO4 + 3H2O
Trabzon je nestabilní a při zahřátí se rozkládá na vodík a volný arsen, který vytváří černý povlak na chladných částech zařízení (Arsene mirror), což je kvalitativní reakce na arsen.
Pro sloučeniny vodíku EN3 jsou nejcharakterističtější reakce interakce s vodou, oxidační reakce a substituce atomu vodíku.
Při přechodu od amoniaku k fosfinu se rozpustnost ve vodě a základní vlastnosti prudce snižují. Fosfin, Arsinoe, stibin jsou látky špatně rozpustné ve vodě. Ve vodných roztocích prakticky nevykazují základní vlastnosti. Fosfin je zároveň kyselina (ale kyselé vlastnosti jsou velmi slabé): aktivní kovy v něm nahrazují jeden vodík za vzniku fosfonidů MePH2.
Amoniak je na rozdíl od hydridů jiných pniktogenik velmi dobře rozpustný ve vodě (jeden objem vody rozpustí 1200 objemů NH3), což se vysvětluje tvorbou vodíkových vazeb a hydrátů NH3 · nH2O různého složení. Amoniak se snadno odpařuje, takže i zředěné roztoky mají charakteristický zápach.
Vodný roztok amoniaku vykazuje vlastnosti slabé báze:
NH3 + H2O ↔ NH4 + + OH-
Přítomnost volného sp2-hybridního elektronového páru vede k jeho donorovým vlastnostem - schopnosti interagovat s kyselinami za vzniku amonných solí a také vytvářet komplexní sloučeniny - amoniak:
NH3 + HCl -> NH4Cl
NiCl2 + 6 NH3 -> Cl2.
Amonné soli se vyznačují nízkou tepelnou stabilitou a při zahřívání se rozkládají na různé produkty v závislosti na zbytku kyseliny.
Alkalické kovy reagují s amoniakem za vzniku amidů:
NH3 + Na → NaNH2 + ½ H2
Jiné kovy reagují s amoniakem za vzniku nitridů:
3 μg + 2 NH3 → 3 μgN3 + 3 H2
Kromě stechiometrických nitridů je možná tvorba nestechiometrických sloučenin, například TiN.
Fluor okamžitě oxiduje amoniak na NF3. V přítomnosti jiných halogenů se nahrazují atomy vodíku, jejichž reakční produkty závisí na kyselosti, teplotě a stabilitě vzniklých sloučenin.
Regenerační vlastnosti:
Atomy prvků v EN3 jsou v nejnižším oxidačním stupni, takže hydridy vykazují redukční vlastnosti.
Amoniak nehoří na vzduchu, ale hoří v kyslíkové atmosféře:
– Bez katalyzátoru: 4NH3 + 3O2 → 2N2 + 6H2O.
– S platinovým katalyzátorem: 4NH3 + 5O2 → 4NO + 6H2O.
Fosfin tvoří se vzduchem výbušné směsi a po zapálení hoří za vzniku metafosfátové kyseliny:
РH3 + 2O2 → HPO3 + H2O.
Trabzon a stibin při spalování tvoří oxid:
2 EH3 + 3 O2 -> E2O3 + 3H2O.
Při zvýšených teplotách je amoniak schopen redukovat některé oxidy kovů:
2NH3 + 3CuO -> 3Cu + N2 + 3H2O.
Fosfin, Arsinoe a stibin jsou silnější redukční činidla, redukují soli těžkých kovů.
Amonné soli jsou stabilnější než fosfoniové soli. Mohou interagovat s kyselinami, zásadami a jinými solemi
NH4Cl + HNO3 -> NH4NO3 + HCl;
2NH4Cl + Ba (OH) 2 -> 2NH3 + 2H2O + BaCl2;
(NH4) 2SO4 + BaCl2 → BaSO4 ↓ + 2NH4Cl.
Amonné soli, ve kterých aniont není oxidačním činidlem, se při zahřívání rozkládají zpět:
NH4Cl ↔ NH3 + HCl
(NH4) 2SO4 ↔ 2NH3 + Н2SO4
Pokud je anion oxidační činidlo, pak se soli zcela rozloží:
NH4NO3 -> N2O + 2H2O.
Kovové fosfidy pod vlivem vody zcela hydrolyzují:
Mg3P2 + 6H20 -> 3Mg (OH)2 + 2PH3.
Kromě amoniaku tvoří dusík s vodíkem další sloučeniny, například hydrazin N2H4 (oxidační stupeň dusíku 2). Hydrazin je kapalina štiplavého zápachu, jako čpavek, schopná ionizace, slabší báze než čpavek, velmi silné redukční činidlo. НN3 – kyselina dusičná (formální oxidační stav dusíku je -1/3 – НNN2, jeden atom dusíku má oxidační stav +5, druhý -3) – bezbarvá kapalina, štiplavého zápachu, výbušná. Velmi silné redukční činidlo, poměrně silná kyselina.
4.7 kyslíkaté sloučeniny prvků skupiny V A
SLOUČENINY kyslík-dusík
Dusík s kyslíkem tvoří šest oxidů: N2O, NO, N2O3, NO2, N2O4, N2O5 (kromě toho jsou známy ještě dva nestabilní oxidy: N4O, NO3). První dva oxidy nejsou solné. Jiné při interakci s vodou tvoří odpovídající kyseliny - dusitany a dusičnany.
Všechny oxidy dusíku lze získat interakcí kovů různé aktivity s kyselinou dusičnou nebo rozkladem dusičnanů při teplotě. Pouze NO lze získat přímou syntézou z jednoduchých látek za vysokých teplot (vzniká i v atmosféře při výbojích blesku).
Oxidační stav +1:
Oxid dusnatý, N2O je průhledný plyn bez zápachu se sladkou chutí, rozpustný ve vodě. Při vdechování ve významných množstvích vzrušuje nervový systém, a proto se mu také říká „smějící se plyn“.
N2O se získává rozkladem dusičnanu amonného při 200oC:
NH4NO3 -> N2O + 2H2O.
N2O nereaguje s vodou, kyselinami a zásadami. Má oxidační vlastnosti, ale při interakci se silnými oxidačními činidly se chová jako redukční činidlo:
2N2O + 6Сl2 → 4NCl3 + O2.
Oxidační stav +2:
Oxid dusíku (II), NO je průhledný plyn, rozpouští se ve vodě, ale nereaguje s ní.
V laboratoři se získává reakcí:
3Cu + 8HNO3 -> 3Cu (NO3)2 + 2NO + 4H2O.
V průmyslu se NO získává katalytickou oxidací NH3 na platino-rhodiovém katalyzátoru při 700 oC:
4NH3 + 5O2 -> 4 NO + 6H2O.
Při reakcích NO zpravidla vykazuje redukční vlastnosti - odbarvuje roztok KMnO4 a snadno se oxiduje kyslíkem:
2NO + O2 → 2NO2.
Ale může to být také oxidační činidlo:
2NO + 2H2 ->N2 + 2H20.
Oxidační stav +3:
Oxid dusnatý (iii), N2O3 je tmavě modrá kapalina (existuje také v plynném a pevném skupenství zároveň). Již při nízkých teplotách se rozkládá na NO a NO2:
N2O3 → NO + NO2.
S vodou N2O3 tvoří kyselinu dusitou: N2O3 + H2O → 2HNO2.
HNO2 je slabá, nestabilní kyselina, vykazuje redoxní dualitu, existuje pouze ve zředěných roztocích a s rostoucí teplotou se rozkládá:
3HNO2 → HNO3 + 2NO + H2O.
Oxidační stav +4:
Oxid dusíku (IV), NO2 je hnědý plyn s charakteristickým zápachem, vysoce rozpustný ve vodě. NO2 po ochlazení dimerizuje za vzniku bezbarvé kapaliny N2O4.
Lze jej získat vystavením mědi koncentrované kyselině dusičné nebo rozkladem při zahřívání dusičnanů kovů, které jsou v rozsahu napětí od hořčíku po měď:
Cu + 4HN03 -> Cu (N03)2 + 2N02 + 2H20;
2Pb (NO3) 2 → 2PbO + 4NO2 + O2.
Interakci NO2 s vodou lze zapsat takto:
6NO2 + 2H2O -> 4HNO3 + 2NO.
NO může být oxidován vzdušným kyslíkem, takže jediným produktem reakce NO2 s vodou v přítomnosti přebytku vzduchu je kyselina dusičná
4NO2 + O2 + 2H2O → 4HNO3.
Tato reakce se používá k výrobě kyseliny dusičné v průmyslu.
NO2 je silné redukční činidlo, v jehož atmosféře hoří síra, uhlík a mnoho kovů. Může být považován za směsný anhydrid kyseliny dusičné a dusité, protože po rozpuštění ve vodě tvoří směs těchto kyselin:
2NO2 + H2O → HNO2 + HNO3
Dusitanový dusík
kyselá kyselina
Oxidační stav +5:
Oxid dusnatý (V) nebo anhydrid dusnatý, N2O5 je bílá pevná krystalická látka, silné oxidační činidlo, vykazuje kyselé vlastnosti: v důsledku rozpouštění ve vodě tvoří kyselinu dusičnou, s alkáliemi tvoří soli kyseliny dusičné - dusičnany.
N2O5 lze získat reakcí:
2HNO3 + P2O5 -> 2HP03 + N2O5;
Při zahřátí se rozkládá podle rovnice:
2N2O5 → 4NO2 + O2.
HNO3 – kyselina dusičná nebo dusičná – těkavá bezbarvá kapalina štiplavého zápachu, mísitelná s vodou v libovolném poměru, bod tání = -420C, bod varu = 830C.
Při teplotě se rozkládá a uvolňuje NO2, který jej zbarví do žluta:
4HNO3 -> 4NO2 + O2 + 2H2O.
Poprvé byla kyselina dusičná získána U.F. Glauber působením kyseliny sírové na ledek. Nyní se tato metoda používá v laboratoři k získání kyseliny dusičné: NaNO3 + H2SO4 → NaHSO4 + HNO3.
Průmysl používá k výrobě kyseliny dusičné čpavkovou metodu: 4NH3 + 5O2 4NO + 6H2O
4NO + 2O2 → 4NO2
4NO2 + O2 + 2H2O 4HNO3
Amoniaková metoda umožňuje získat 50% kyselinu dusičnou. 98% HNO3 se získává destilací 50% kyseliny dusičné v přítomnosti H2SO4. Kyselina dusičná se vyrábí také obloukovou metodou, první fází tohoto procesu je tvorba NO z jednoduchých látek při 30 000C.
Kyselina dusičná je silný elektrolyt a silné oxidační činidlo, proto se některé kovy působením kyseliny dusičné pasivují, jiné redukují dusík kyseliny dusičné v různých oxidačních stavech (v závislosti na povaze redukčního činidla a koncentraci kyseliny ), ale kovy nikdy nevytěsňují vodík z roztoků kyseliny dusičné.
Koncentrovaná kyselina dusičná má nejsilnější oxidační vlastnosti:
s alkalickými kovy a kovy alkalických zemin Na, Ca, Ba, Mg se redukuje na N2O, např.
Mg + 10HNO3 (konc.) → 4 μg (NO3) 2 + N2O + 5H2O
s těžkými kovy Cu, Ag, Hg se redukuje na NO2, např.
Cu + 4HNO3 (konc.) → Cu (NO3) 2 + 2NO2 + 2H2O
neinteraguje s Fe, Cr, Al, Au, Pt.
Zředěná kyselina dusičná
s alkalickými kovy, kovy alkalických zemin a Fe se redukuje na NH3 (NH4NO3), například:
4Mg + 10HNO3 (přerušovač) → 4Mg (NO3) 2 + NH4NO3 + 5H2O
– Těžkými kovy Cu, Ag, Hg se redukuje na NO, např.
3Cu + 8HNO3 (přestávka.) → 3Cu (NO3) 2 + 2NO + 4H2O
Při interakci nekovů (C, S, P, Si) s koncentrovanou kyselinou dusičnou se dusík redukuje na NO2 a se zředěnou kyselinou dusičnou se redukuje na NO, například:
5HN03 (konc.) + P -> H3PO4 + 5NO2 + H2O;
5HNO3 (přerušovač) + 3P + 2H2O → 3H3PO4 + 5NO.
Směs skládající se z 1 objemového dílu koncentrované kyseliny dusičné a 3 objemových dílů koncentrované kyseliny chlorovodíkové se nazývá „silná (královská, knížecí) voda“, „královská vodka“. V této směsi se rozpouštějí i ušlechtilé kovy, které s kyselinou dusičnou neinteragují (vysvětluje se to tvorbou velmi silného, nestabilního oxidačního činidla NOCl - nitrosylchloridu).
Au + HNO3 + 4HCl → H + NO + 2H2O
3Pt + 4HNO3 + 18HCl → 3H2 + 4NO2 + 8H2O
Soli kyseliny dusičné - dusičnany, se dobře rozpouštějí ve vodě a při zahřívání se rozkládají za uvolňování kyslíku:
Dusičnany alkalických kovů a kovů alkalických zemin se rozkládají na dusitany:
2NaN03 -> 2NaN02 + O2;
dusičnany kovů v rozsahu napětí od Mg do Cu se rozkládají na oxid kovu: 2Pb (NO3) → 2PbO + 4NO2 + O2;
dusičnany nejméně aktivních kovů (stříbro, zlato, platina) se zahřátím na volný kov rozkládají:
2AgNO3 → 2Ag + 2NO2 + O2.
Kyslíkaté sloučeniny fosforu, arsenu, antimonu a vizmutu
Oxidační stav +3
Oxidy E2O3 vznikají interakcí jednoduchých látek s kyslíkem. Pokud však v případě As, Sb, Bi oxidy vznikají i při přebytku kyslíku, pak musí být proces oxidace fosforu přísně kontrolován. Oxid fosforečný (iii) P2O3 (kvůli přítomnosti nesdíleného elektronového páru existuje jako dimer P4O6). P4O6 – bílá sypká krystalická látka (Bp. = 174°C, teplota tání = 24°C), vznikající při pomalé oxidaci fosforu při 50°C a 90 mm
V teplotním rozmezí 20-50°C se oxiduje vzdušným kyslíkem (za přítomnosti stop fosforu - samovolně):
Р4О6 + 2О2 → Р4О10, tento proces je doprovázen chemiluminiscencí a je příčinou záře bílého fosforu.
S vodou tvoří kyselinu trioxofosfátovou (V):
P4O6 + 6H20 -> 4H3PO3
Podle strukturního vzorce je tato kyselina dvojsytná:
Vzniká, když chlorid fosforitý reaguje s vodou:
PCl3 + 3H20 -> 3HCl + H3PO3.
Ve volném stavu je H3PO3 bezbarvá krystalická látka, vysoce rozpustná ve vodě a alkoholu. Je to poměrně silné redukční činidlo (silnější redukční činidlo než kyselina dusná), které redukuje kovy z jejich solí.
Ve skupině shora dolů je kyselá povaha oxidů nahrazena zásaditou:
Oxid arsenitý (iii) nebo anhydrid arsenu As2O3 odpovídá hydroxidu arzenitému – amfoternímu hydroxidu, u kterého převažují kyselé vlastnosti:
As2O3 + 3H2O → 2As (ОH) 3 ↔ 2 H3AsO3.
H3AsO3 – hydrogentrioxoarsenát (iii) existuje pouze ve vodném roztoku. Soli této kyseliny se nazývají arsenity, lze je získat reakcí:
As203 + 6KOH -> 2K3As03 + 3H2O
arsenitan draselný
Sloučeniny arsenu (iii) mají redukční vlastnosti, v důsledku jejich oxidace vznikají sloučeniny arsenu (V).
Sb2O3 – antimon (iii) oxid nebo stibatanhydrid – amfoterní oxid: Sb2O3 + 3H2SO4 → Sb2 (SO4) 3 + 3H2O;
Sb2O3 + 3NaOH → 2NaSbO2 + H2O
Bi2O3 je bazický oxid, který se rozpouští v kyselinách a tvoří soli vizmutu. Hydroxid bismutitý (iii), Bi (OH) 3 je velmi slabá báze, proto soli vizmutu (iii) hydrolýzou za vzniku špatně rozpustných bazických solí. Během hydrolýzy Bi (NO3) 2 často vzniká oxosyl:
Bi (NO3) 2 + H2O → BiОNO3 + 2NNO3.
Oxidační stav +5
Oxid fosforečný – P2O5 (anhydrid kyseliny fosforečné) – bílý drobivý prášek, roztírá se na vzduchu. Hexagonální modifikace, která vzniká při spalování fosforu v přebytku kyslíku, je postavena z molekul P4O10. Intenzivně reaguje s vodou za vzniku komplexní směsi skládající se z metafosfátových kyselin, které při varu hydrolyzují na kyselinu ortofosforečnou. Reakce je doprovázena silným zahřátím:
PODÍL:
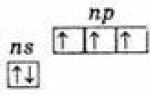
ns 2 np 3.
DUSÍK a jeho sloučeniny
V přírodě se nachází ve volné formě (obsah ve vzduchu - 78 obj. %), ve formě minerálů (ledek), v oleji, v rostlinných a živočišných bílkovinách.
Fyzikální vlastnosti
Za normálních podmínek je N 2 bezbarvý plyn bez zápachu a chuti.
t o kip. = -195,8 °C.
Produkce dusíku:
a) v průmyslu - zkapalňování vzduchu,
b) v laboratoři: NH 4 NO 2 ® N 2 + H 2 O.
Chemické vlastnosti dusíku a jeho sloučenin.
Chemická aktivita molekulárního dusíku je velmi nízká, protože díky trojné kovalentní vazbě je molekula velmi pevná (E vazba = 946 kJ/mol). Pro dusík je však známo mnoho různých sloučenin, ve kterých vykazuje oxidační stavy -3, -2, -1, +1, +2, +3, +4, +5.
Sloučeniny dusíku s negativním oxidačním stavem.
3
1)NH 3 – amoniak– bezbarvý plyn se štiplavým zápachem, snadno zkapalněný.
Výroba amoniaku:
a) N2 + 3H2 « 2NH3 (Kat: Fe, Al203, K20)
b) 2NH4CI + Ca(OH)2 = CaCI2 + 2NH3 + 2H20
Chemické vlastnosti amoniaku:
a) NH 3 + H 2 O « NH 4 OH (maximální koncentrace = 25 %)
b) NH 3 + HCI « NH 4 CI (mechanismus don.-ac.: NH 3 + H + = NH 4 +)
c) spalování probíhá různě v závislosti na množství kyslíku:
4NH3 + 3O2 (týden) = 2N2 + 6H20
4NH3 + 502(g) = 2NO+ 6H20
d) v OVR je amoniak vždy redukčním činidlem:
3CuO + 2NH3 = 3Cu + N2 + 3H20
2) NH 4 OH – hydroxid amonný- slabá báze, nestabilní, dobře tvoří komplexní sloučeniny (amoniak):
Cu(OH)2 + 4NH4OH = (OH)2 + 4H20
3) Amonné soli:
a) roztoky v důsledku hydrolýzy mají mírně kyselou reakci:
NH 4 CI + HON « NH 4 OH + HCI (NH 4 + + HON « NH 4 OH + H +)
b) tepelný rozklad amonných solí probíhá odlišně v závislosti na povaze aniontu: je-li aniont oxidační činidlo, pak je rozkladná reakce nevratná:
NH4CI « NH3 + HC1
NH4NO3 = N20+ 2H20
4) Amidy vznikají, když jsou atomy H v amoniaku nahrazeny kovem:
2K + 2NH3 = 2KNH2 + H2
5) Nitridy známé pro kovy a nekovy a v závislosti na jejich povaze se rozkládají odlišně:
a)Li3N + 3H20 = 3LiOH + NH3
Ca3N2 + 6HC1 = 3CaCI2 + 2NH3
b) CI3N + 6HC1 = 3HCIO + NH3
Oxidační stav - 2
N 2 H 4 – hydrazin(diamid) je bezbarvá kapalina, dobré rozpouštědlo, méně stabilní než amoniak.
Příprava hydrazinu:
2NH3 + NaCIO = N2H4 + NaCI + H20
Chemické vlastnosti hydrazinu:
N2H4 + H20 « + +OH -
H2O « 2+ +OH -
b) Hoří na dusík: N2H4 + O2 = N2 + 2H20
c) Silné redukční činidlo: N 2 H 4 + 2H 2 O 2 = N 2 + 4H 2 O
Oxidační stav - 1
NH 2 OH – hydroxylamin, bílá krystalická látka, zaujímá mezilehlou polohu mezi H 2 O 2 a hydrazinem N 2 H 4.
Příprava hydroxylaminu:
HN03 + 6H = NH20H + 2H20
Chemické vlastnosti hydroxylaminu:
a) Vodné roztoky – slabé zásady:
NH 2 OH + H 2 O « + + OH -
b) Hydroxylamoniové soli (stabilní) jsou uvedeny s kyselinami:
NH2OH + HC1 = + + CI -
c) Rozkládá se (disproporční reakce):
3NH20H = NH3 + N2 + 3H20
d) Stejně jako H 2 O 2 vykazuje v závislosti na prostředí redoxní dualitu:
OK: 2NH2OH + 4FeSO4 + 3H2SO4 = 2Fe2(SO4)3 + (NH4)2SO4 + 2H20
obnoveno: 2NH2OH + I2 + 2KOH = N2 + 2KI + 4H20
Nejdůležitější sloučeniny dusíku s kladným s. Ó.
Oxidační stav + 3
1) N203- oxid dusnatý (III) nebo „anhydrid dusný“ je nestabilní modrozelená kapalina:
a) N 2 O 3 ® NO 2 (hnědý plyn se štiplavým zápachem) + NO (bezbarvý plyn);
b) tvoří s vodou nestabilní kyselinu: N 2 O 3 + H 2 O « 2 HNO 2
2) HNO2– kyselina dusitá (středně silná):
HN02«H+ + N02- (K = 5,1 . 10 -4).
3) Dusitany– soli kyseliny dusité, stejně jako jiné sloučeniny N+3 v redoxních reakcích, vykazují dualitu:
OK: KN02 + NH3 = N2 + H20
obnoveno: KNO2 + H202 = KNO3 + H20
Maximální oxidační stav + 5
1) N205- oxid dusnatý (V) nebo „anhydrid dusnatý“ je bezbarvá krystalická látka; Po rozpuštění ve vodě dává kyselinu.
2) HNO3– kyselina dusičná, silná: HNO 3 ® H + + NO 3 - .
3) Dusičnany– soli kyseliny dusičné:
a) v laboratoři můžete získat N 2 O reakcí tepelného rozkladu: NH 4 NO 3 ® N 2 O + H 2 O;
b) dusičnany kovů se v závislosti na poloze kovu v řadě aktivit rozkládají různě:
vlevo Mg: dusičnan ® dusitan + O 2
Mg – Cu: dusičnan ® oxid kovu + NO 2 + O 2
vpravo Cu: dusičnan ® kov + NO 2 + O 2 .
4) všechny sloučeniny N+5 jsou silná oxidační činidla; interakce kyseliny dusičné s kovy:
a) žádný kov neuvolňuje vodík z HN03;
b) při normálním t jsou pasivovány kovy Al, Zn, Cr, Fe, Pb, Au, Pt;
c) při zahřátí interaguje s většinou kovů a čím aktivnější je kov a čím je kyselina zředěnější, tím silnější je redukce N +5:
neaktivní Meh: Cu + 4HNO 3 (konc.) = Cu (NO 3) 2 + 2NO 2 + 2H20
3Cu + 8HNO3(zředěný) = 3Cu(NO3)2 + 2NO + 4H20
aktiva. Meh: 4Ca + 10HNO3(konc.) = 4Ca(NO3)2 + N2O + 5H2O
5Ca + 12HNO3(zředěný) = 5Ca(NO3)2 + N2 + 6H2O
4Ca + 9HNO3 (ultrazředěný) = 4Ca(NO 3) 2 + NH 3 (nebo NH 4 NO 3) + 3H 2O
FOSFOR a jeho sloučeniny
V přírodě se vyskytuje: a) ve formě minerálů (fosfority a apatity), b) v rostlinných a živočišných bílkovinách, c) v mozkové tkáni a kostech.
Fyzikální vlastnosti
Allotropen:
A) bílý fosfor(P 4) – čtyřstěnná struktura, jedovatá, ve tmě svítí, rozpustná v sirouhlíku; při skladování se postupně mění na červený fosfor, takže se skladuje pod vodou;
b) červený fosfor(P 2 n – polymer) – existuje více forem struktury, netoxický, nerozpustný v sirouhlíku, stabilní při skladování, méně reaktivní;
PROTI) černý fosfor– pyramidální struktura, vrstvená, podobná grafitu, polovodič.
Získání fosforu:
Fosforitový minerál je kalcinován koksem a pískem:
Ca 3 (PO 4) + 5C + 3 SiO 2 = 3CaSiO 3 + 2P + 5CO
Chemické vlastnosti fosforu a jeho sloučenin.
Chemická aktivita fosforu se mění v závislosti na jeho alotropní modifikaci. Hlavní oxidační stavy: -3, +1, +3, +5.
1) Reakce fosforu s jednoduchými látkami:
regenerační vlastnosti: a)P+02®P203, P205;
b)P + CI2® PCI3, PCI5; c) 2P + 3S® P2S3
oxidační vlastnosti: a) 2P + 3H 2 ® 2РН 3, b) 2P + 3Ca ® Ca 3 P 2
2) Reakce fosforu s komplexními látkami:
a) nedochází k reakci s vodou,
b) 2P + 5H2S04 (konc.) ® 2H3P04 + 5S02 + 2H20,
c) P + HNO 3 (konc.) ® H3P04 + NO (nebo NO 2).
3)Minimální oxidační stav - 3
A) PH 3– fosfin, jedovatý plyn s česnekovým zápachem,
rozsvíceno: 2РH3 + 4О2 = Р2О5 + 3H20,
s některými kyselinami poskytuje fosfoniové soli: РH 3 + HI = РH 4 I
b) fosfidy kovů– ionokovalentní sloučeniny
Mg3P2 + 6 H20 = Mg(OH)2 + 2РН 3,
Ca3P2 + 6HC1 = CaCI2 + 2PH3.
4)Oxidační stav + 1
H 3 PO 2 nebo H[PO 2 H 2 ] – kyselina fosforná, silná; soli jsou fosfornany, vysoce rozpustné, dobrá redukční činidla.
5)Oxidační stav + 3
a) P 2 O 3 – anhydrid fosforu, má několik modifikací (P 2 O 3) n, bezbarvé jedovaté krystaly;
b) H 3 PO 3 nebo H 2 [PO 3 H] – kyselina fosforitá, středně silná;
c) fosfitové soli, rozpustné pouze v alkalických kovech (K 2 [PO 3 H]),
PCI 3 + CI 2 = PCI 5,
PCI 3 + O 2 = PCI 3,
PCI3 + HCI® N.
6)Maximální oxidační stav +5
a) P 2 O 5 – anhydrid fosforu, bílý prášek, má modifikaci (P 2 O 5) 2, silné činidlo odstraňující vodu: P 2 O 5 + 2H 2 O = 2HPO 3;
b) HPO 3 - meta, H 4 P 2 O 7 - pyro, H 3 PO 4 - kyselina ortofosforečná, střední síla;
c) meta-, pyro-, ortho-fosfátové soli;
d) halogenidy jsou poměrně aktivní:
PCI5 + 4H20 = H3P04 + 5HCI,
RF5 + HF = N.
VŠEOBECNÉ CHARAKTERISTIKY PODSKUPINY
7 N, 15 P, 33 As, 51 Sb, 83 Bi. V podskupině shora dolů se kovové vlastnosti přirozeně zvyšují, což je v souladu s hodnotami oxidačních stavů, které vykazují prvky ve sloučeninách, a také s některými fyzikálními vlastnostmi. Ačkoli alotropie P, As a Sb vytváří určité potíže při kombinování fyzikálních vlastností do jedné tabulky:
Tabulka 11
Vlastnosti prvků páté skupiny, hlavní podskupiny
Chemické vlastnosti
1. Různé sloučeniny se vyrábějí s jednoduchými látkami, které vykazují různé redoxní vlastnosti:
a) obnovující vlastnosti
2P + 3C12 = 2PCI3 (nebo PCI5);
4As + 502 = 2As205;
2Bi + 3Cl2 = 2BiCl3.
b) Oxidační vlastnosti
2P + 3Ca = Ca3P2;
2As + 3Mg = Mg3As 2.
2. Reagují s kyselinami různě v závislosti na povaze prvku podskupiny:
2P + 5H2S04 = 2H3P04 + 5S02 + 2H20;
3As + 5HN03 + 2H20 = 3H3As04 + 5NO;
3Sb + 5HN03 = 3HSb03 + 5NO + H20;
2Sb + 6H2S04 konc. = Sb2(S04)3 + 3S02 + 6H20;
Bi + 4HN03 = Bi(N03)3 + NO + 2H20.
Je třeba mít na paměti, že prvky podskupiny arsen se v řadě aktivit objevují po vodíku.
3. Hydrolýza sloučenin probíhá různými způsoby:
a) PCI3 + 3H20 = H3P03 + 3HCl;
BiCl 3 + H 2 O ® BiOCl ¯ + 2 HCl.
(SbCl 3) (SbOCl)
b) NaN02 + H20 Û HN02 + NaOH;
K 3 P0 4 + H 2 O Û K 2 HPO 4 + KOH;
K 3 AsO 4 + H 2 O Û K 2 HAsO 4 + KOH.
4. Změny acidobazických vlastností prvků se projevují různými způsoby
Tabulka 12
Nejdůležitější sloučeniny prvků páté podskupiny
5. Redoxní schopnost sloučenin závisí na stupni oxidace prvku:
A) E-3– redukční činidla
2NH3 + 6KMn04 + 6KOH = 6K2Mn04 + N2 + 6H20;
2PH3 + 402 = P205 + 3H20.
oxidační činidla:
2KNO2 + 4H2S = 3S + N2 + K2S + 4H20
E +3 2BiCl3 + 3SnCl2 + 18KOH = 2Bi + 3K2Sn03 + 12KCl + 9H20.
redukční činidla:
10KNO2+4KМnO4+11H2SO4=10HNO3+4MnSO4+7K2SO4+6H2O
PROTI) E +5 – oxidační činidla
Na 3 SbO 4 + 2NaJ + H 2 SO 4 = Na 3 SbO 3 + J 2 + Na 2 SO 4 + H 2O.
Prvky skupiny 6. (Chalkogeny)
Struktura elektronického pláště:... ns 2 np 4.
8 O, 16 S, 34 Se, 52 Te, 84 Po (radioaktivní).
KYSLÍK a jeho sloučeniny
Nejběžnější prvek na Zemi: 21 % (objemových) ve vzduchu, je součástí H 2 O, minerálů a organických látek.
Fyzikální vlastnosti
Existuje ve formě látek:
a) „kyslík“ O 2 – plyn bez barvy, chuti, zápachu, netoxický; t° varu. = -183 °C; ;
b) „ozón“ O 3 – modrý plyn štiplavého zápachu, jedovatý, velmi silné oxidační činidlo; t° varu. = -111,8 °C.
Chemické vlastnosti
1. Pouze v jedné reakci je kyslík redukčním činidlem:
02 + 2F2 = 2OF2 ().
2. Ve všech ostatních případech je kyslík oxidačním činidlem, zejména pokud je v atomovém stavu:
a) Oxidace jednoduchých látek
2H2+02 = 2H20;
S + 02 = S02;
2Ca + O2 = 2CaO.
b) Oxidace komplexních látek
R203 + 02 = R205;
2S02 + 02 = 2S03;
2PCI3 + O2 = 2POCI3.
c) Spalování složitých anorganických látek
2H 2 S + O 2 nedostatečné = 2S + 2H20;
2H2S + 302 g. = 2S02 + 2H20.
d) Spalování organických látek
CH4+202 = C02 + 2H20;
C2H5OH + 302 = 2C02 + 3H20.
SÍRA a její sloučeniny
Nachází se v přírodě v přirozené formě; ve formě minerálů (sulfidy, sírany); v oleji; v proteinech.
Fyzikální vlastnosti
Tvrdý, křehký, žlutý, nerozpustný v H 2 O, ale rozpustný v sirouhlíku a anilinu. Alotropní: kosočtverečná síra (a-forma); monoklinický (b - síra); plast atd. Nejstabilnější modifikace je a (t° pl. » 113°C), připisuje se jí složení S 8.
Chemické vlastnosti
Sloučeniny vykazující různé stupně oxidace mají různé redoxní schopnosti.
Tabulka 13
Nejdůležitější sloučeniny síry
1. Síra, interagující s komplexními sloučeninami, mění svůj oxidační stav různými způsoby:
a) S + 2H2S04 konc. = 3S02 + 2H20 ();
b) S + 6HNO3 konc. = H2S04 + 6N02 + 2H20 ();
c) 3S + 6NaOH = 2Na2S + Na2S03 + 3H20
disproporční reakce
2. Připojení S-2
A) H2S– sirovodík, jedovatý plyn se zápachem zkažených vajec, silné redukční činidlo: 2H 2 S + O 2 = 2S + 2H 2 O;
H2S + Cl2 = 2HCl + S.
b) roztok H 2 S – slabá kys
H2SÛN+ + HS- (Ki = 6 x 10-8).
c) Soli – sulfidy; soli alkalických kovů a kovů alkalických zemin jsou vysoce rozpustné a hydrolyzují; sulfidy p- a d-kovů jsou prakticky nerozpustné.
G) Sulfidy výstava kovů hlavní Příroda:
K 2 S + H 2 O Û KHS + KOH;
Nekovové sulfidy vykazují kyselý Příroda:
SiS2 + 3H20 = H2Si03 + 2H2S.
d) Thiosoly: podobně jako běžné soli, ve kterých jsou atomy O nahrazeny S:
Na 2 S + CS 2 = Na 2 CS 3 – thiokarbonát sodný;
Na2CS3 + 2HCl = 2NaCl + H2CS3
nestabilní
E) Polysulfidy: síra, stejně jako kyslík v peroxidech, může tvořit soli: roztok Na 2 S + ´S = Na 2 S n - polysulfid sodný (obsahuje sulfidové můstky - S - S - S - S -).
3. S+4 připojení
a) SO 2 – oxid siřičitý štiplavého zápachu, jedovatý;
b) roztok SO 2 - kyselina siřičitá H 2 SO 3, středně silná
H2SO3Û H+ + HSO3- (Ki = 1,3 x 10-2);
c) Soli – siřičitany, dobře hydrolyzují
Na 2 SO 3 + H 2 O Û NaHS0 3 + NaOH.
d) Při redoxních reakcích vykazují všechny tyto sloučeniny dualitu:
S02 + 2H2S = 3S + 2H20;
2SO 2 + O 2 = 2SO 3.
e) thionylchlorid: SOCI2
SOCI2 + 2H20 = H2S03 + 2HCl.
4. S+6 připojení
A) TAK 3– anhydrid kyseliny sírové; alotropní, silné oxidační činidlo. Velmi energicky reaguje s vodou
S03 + H20® H2S04 + 89,1 kJ/mol;
b) H2SO4– kyselina sírová, bezbarvá olejovitá kapalina; silný.
H2SO 4 konc. – velmi silné oxidační činidlo; zuhelnatělý papír, cukr, dřevo:
C + 2H2S04 konc. = C02 + 2S02 + 2H20.
Jednotlivě jeho chování s kovy:
za běžných teplot neinteraguje s mnoha kovy („pasivuje“ Cr, Fe, Al, Zn, ...);
při zvýšených hladinách reaguje téměř se všemi kovy kromě Au a Pt.
Je to velmi dobrý prostředek odstraňující vodu, protože... s vodou tvoří hydráty H 2 SO 4 × nH 2 O:
PROTI) Soli: střední – K 2 SO 4 (sírany);
kyselé – KHSO 4 (sírany vodíku);
vitriol – CuSO4 x 5H20; ZnS04 x 7H20;
kamenec – podvojné soli, krystalické hydráty
KAl(S04)2 x 12H20; NH4Fe(S04)2 x 12H20.
G) Oleum– roztok SO 3 v H 2 SO 4, přičemž reakce částečně probíhá
2SO3 + H20 = H2S207 kyselina pyrosírová.
d) Sulfurylchlorid SO2CI2
S02CI2 + 2H20 = H2S04 + 2HCl.
E) Kyseliny peroxosírové– obsahují peroxidové můstky
H 2 SO 5 – peroxomonosírová,
H 2 S 2 O 8 – peroxodisír;
silná oxidační činidla.
a) Thiosulfáty– obsahují síru v různých oxidačních stavech: S +6 a S -2; díky přítomnosti S-2 jsou sloučeniny silnými redukčními činidly.
Na2S203 + Br2 + H20 = 2HBr + S + Na2S04.
Odpovídající kyselina H 2 S 2 O 3 (thiosírová) je nestabilní:
Na2S203 + H2SO4 = Na2S04 + H2S203.
Prvky skupiny 7a. (Halogeny )
Struktura elektronického pláště:... ns 2 np 5.
9F,17Cl,35Br,53J,85At (radioaktivní). Ve volném stavu existují ve formě dvouatomových molekul.
Fyzikální vlastnosti
Jedovatý, štiplavého zápachu F 2 – světle žlutý plyn, bod varu. = -188,2 °C;
Cl 2 – plyn zelenožlutý; t° varu. = -34,1 °C;
Br 2 – červená kapalina; t° varu. = 59,2 °C;
J 2 – fialové krystaly; t° varu. = +185,5 °C.
Chemické vlastnosti
1) Nejaktivnější je F 2, v jeho atmosféře hoří i sklo a voda:
2F2 + Si02 = SiF4 + 02;
2F2 + 2H20 = 4HF + 02.
2) Předřazené halogeny (jako silnější oxidační činidla) vytlačují halogeny po proudu z různých sloučenin:
F2 + 2KCI (KBr, KJ) = 2KF + Cl2 (Br2, J2).
3) Při rozpuštění halogenů ve vodě a alkalických roztocích dochází k disproporcionačním reakcím; V závislosti na teplotě se získají různé reakční produkty:
Cl2 + H20 = HC1 + HC10;
Cl2 + 2NaOH = NaCl + NaClO;
4) Halogenidy vodíku– všechny jsou to bezbarvé plyny (HF díky vodíkovým vazbám tvoří H x F x asociáty).
V řadě: HF – HCl – HBr – HJ se snižuje pevnost vazby a zvyšují se redukční vlastnosti:
Mn02 + 4HCl = Cl2 + MnCl2 + 2H20 ().
5) Po rozpuštění ve vodě se získají silné kyseliny; HJ je nejsilnější (s výjimkou slabé kyseliny fluorovodíkové:
H 2 F 2 Û H + + HF 2 -)
6) halogenidy prvky mají odlišný acidobazický charakter, který se projevuje:
a) při hydrolytických reakcích
AlCl 3 + H 2 O Û AlOHCl 2 + HCl;
PBr3 + 3H20 = H3P03 + 3HBr.
b) při komplexních formačních reakcích
2NaF + SiF4® Na2;
pro řadu ligandů F-; Cl-; Br-; J - stabilita komplexů klesá.
7) Halogeny ve vyšších oxidačních stavech
a) oxidy: Cl20; (C102)2; (C103)2; Cl 2O 7;
b) kyseliny: HC1O; HC102; HC103; HC104;
u řady kyselin ® se pevnost zvyšuje, u kyselin a jejich solí ve stejné řadě se snižují oxidační vlastnosti.
c) kyseliny a jejich soli se zahřátím rozkládají:
d) sloučeniny mezi halogeny: je jich známo mnoho; Složení odpovídá poloze prvků v periodické tabulce (na konci vzorců se objevuje více elektronegativních prvků):
ClF, BrF, JF; CIF3, JF3; ClF5, ClOF3; BrF7, J03F, atd.;
jsou kyselé povahy: JF7 + 4H20 = 7HF + HJO4;
ClO3F + 2NaOH = NaClO4 + NaF + H20.
Otázky ke konsolidaci materiálu:
1. Jaká látka vzniká při reakci arsenu s koncentrovanou kyselinou dusičnou - a)Аs(NO3)3? b) H 3 AsO 4? c) Jako 2 O 3?
2.Jaká látka reaguje s koncentrovanou kyselinou za uvolnění volného chlóru – a)CaC1 2? b) MnO 2? c) CrC13?
PŘEDNÁŠKA č. 16
TÉMA: 2.1.3. “HLAVNÍ PODSKUPINA SKUPINY V. SLOUČENINY DUSÍKU"
MOTIVACE.
Vzduch obsahuje asi 78 % objemu dusíku.
Dusík je součástí organických a anorganických sloučenin: aminokyselin, bílkovin, dusičnanů atd.
Dusík je surovinou pro výrobu amoniaku, kyseliny dusičné a dusíkatých hnojiv.
Z amoniaku se získává kyselina dusičná, hydroxid amonný atd. Amoniak je široce používán v lékařství.
Kyselina dusičná je jedním z hlavních činidel používaných ve farmacii. analýza. Při práci s kyselinou je třeba dávat pozor. V lékařství se používá ve vypočítaných koncentracích k odstranění bradavic.
Znalost této problematiky je nezbytná pro studium chemických a speciálních oborů.
1. Během přednášky by studenti měli získat znalosti o prvku skupiny V - dusík a jeho sloučeniny: amoniak, amonné soli, oxidy dusíku, kyselina dusičná a její soli, vlastnosti kyseliny dusičné a jejích solí, bezpečnostní opatření při práci s kyselinou dusičnou.
2. Zajistit během lekce osvojení následujících znalostí: - charakteristika prvků skupiny V hlavní podskupiny podle jejich pozice v PSHE pojmenované po. DI. Mendělejev;
Fyzikální a chemické vlastnosti dusíku;
Speciální vlastnosti kyseliny dusičné.
UPS: Témata: „Třídy anorganických sloučenin“,
„Periodický zákon a periodický systém chemických prvků pojmenovaný po. DI. Mendělejev", "Chemická vazba".
"Redoxní reakce"
„Teorie elektrolytické disociace“.
analytická chemie t. "Anionty"
t. „Kach. reakce na anionty I-III gr."
t. "Metoda acidobazické titrace."
Kho-t. "Amins"
T. „Azo a diazosloučeniny
OTÁZKY K AKTUALIZOVANÝM ZNALOSTÍM ŽÁKŮ.
1. Vyjmenujte prvky skupiny V hlavní podskupiny.
2. Jak určit nejvyšší valenci těchto prvků?
3. Proč je nejvyšší valence dusíku rovna třem?
4. Jaké jsou nejvyšší a nejnižší oxidační stavy dusíku?
5. Ve kterých sloučeninách bude mít atom dusíku oxidační stav (− 3)?
6. Jaké oxidy může tvořit dusík?
POŽADAVKY NA VÝSLEDKY Zvládnutí TÉMATU:
Lékárník musí mít obecné kompetence, včetně schopnosti (v základním výcviku):
OK 1. Pochopte podstatu a společenský význam své budoucí profese, projevujte o ni trvalý zájem.
OK 2. Organizovat vlastní aktivity, volit standardní metody a způsoby plnění odborných úkolů, hodnotit jejich efektivitu a kvalitu.
OK 3. Rozhodujte se ve standardních a. nestandardní
situace a nést za ně zodpovědnost. .
OK 4. Hledat a. využívání informací nezbytných pro efektivní plnění odborných úkolů, profesní a osobní rozvoj.
OK 5. Využívat informační a komunikační technologie v odborných činnostech.
OK 6. Pracujte společně a v týmu, komunikujte efektivně
s kolegy, managementem, spotřebiteli.
OK 8. Samostatně určovat úkoly odborných a
osobního rozvoje, zapojit se do sebevzdělávání, vědomě
plán, jak zlepšit své dovednosti.
Lékárník musí mít profesionální
kompetence, odpovídající hlavním typům odborné činnosti (základní školení):
PC 1.6. Dodržovat pravidla sanitárního a hygienického režimu, ochrany práce, bezpečnosti a požární bezpečnosti.
PC 2.3. Mít požadované typy intrafarmaceutické kontroly
léky.
PC 2.4. Dodržovat pravidla sanitárního a hygienického režimu, ochrany práce, bezpečnosti a požární bezpečnosti.
PLÁN PŘEDNÁŠEK.
1. Obecná charakteristika prvků skupiny V hlavní podskupiny periodického systému D. I. Mendělejeva.
2. Biologická role dusíku (nezávisle)
3.Dusík. Charakteristika dusíku na základě jeho postavení v periodické tabulce, z hlediska teorie struktury atomu, oxidačního stavu, fyzikálních vlastností, distribuce v přírodě, způsobů výroby, chemických vlastností. Nejdůležitější sloučeniny dusíku.
4. Amoniak, způsoby jeho výroby, fyzikální a chemické vlastnosti.
5. Amonné soli, způsoby přípravy, vlastnosti. Kvalitativní reakce na amonný kation.
6. Aplikace dusíku a jeho sloučenin v lékařství a národním hospodářství. (na vlastní pěst).
7. Oxidy dusíku. Kyselina dusitá. Dusitany.
Kvalitativní reakce na dusitanové ionty.
8. Kyselina dusičná, způsoby výroby, fyzikální a chemické vlastnosti, bezpečnostní opatření při provozu. Dusičnany.
9.Kvalitativní reakce na dusičnanové anionty
I. OBECNÉ CHARAKTERISTIKY PRVKŮ SKUPINY V HLAVNÍ PODSKUPINY.
Z prvků PS skupiny V je hlavní skupinou zájmu pro medicínu hlavní skupina, která zahrnuje dusík, fosfor, arsen, antimon a vizmut.
Ve vnější vrstvě atomu těchto prvků je pět elektronů, takže schopnost přidávat elektrony je u nich méně výrazná než u odpovídajících prvků skupin VI a VII. Na druhou stranu prvky hlavní podskupiny V gr. předávají elektrony snadněji než prvky skupin VI a VII, proto jsou jejich kyslíkaté sloučeniny stabilnější. V důsledku toho prvky podskupiny vykazují pozitivní i negativní oxidační stavy.
Nejvyšší kladný oxidační stav prvků této podskupiny
Vzhledem k relativně nižšímu EO je vazba těchto prvků s vodíkem méně polární než vazba s vodíkem prvků skupin VI a VII. V důsledku toho nedochází k odštěpení vodíkových sloučenin příslušných prvků
ve vodném roztoku jsou vodíkové ionty, a proto nemají kyselé vlastnosti
Závěry:
1. Ve vnější vrstvě atomu prvků PS skupiny V je pět elektronů;
2. Jejich schopnost přidávat elektrony je méně výrazná než u odpovídajících prvků skupin VI a VII;
3. Prvky hlavní podskupiny V gr. předávají elektrony snadněji než prvky skupin VI a VII;
4. Nejvyšší kladný oxidační stav prvků této podskupiny
rovná se + 5 a záporné - 3.
Podskupinu dusíku tvoří pět prvků: dusík, fosfor, arsen, antimon a vizmut. Jedná se o p-prvky skupiny V periodického systému D.I. Mendělejeva.
Na vnější energetické úrovni obsahují atomy těchto prvků pět elektronů, které mají konfiguraci ns2np3 a jsou distribuovány následovně:

Proto je nejvyšší oxidační stav těchto prvků +5, nejnižší -3 a typický je také +3.
Přítomnost tří nepárových elektronů na vnější úrovni naznačuje, že v neexcitovaném stavu mají atomy prvků valenci 3. Vnější úroveň atomu dusíku se skládá pouze ze dvou podúrovní - 2s a 2p. Atomy zbývajících prvků této podskupiny mají na vnějších energetických hladinách prázdné buňky d-podúrovně. Následně se jeden z s-elektronů vnější hladiny může po excitaci přesunout do d-podúrovně stejné hladiny, což vede ke vzniku 5 nepárových elektronů.

vnější elektronový obal fosforu (neexcitovaný atom)

vnější elektronový obal excitovaného atomu fosforu.
Fosfor, arsen, antimon a vizmut v excitovaném stavu mají tedy 5 nepárových elektronů a jejich valence v tomto stavu je 5.
V atomu dusíku je nemožné excitovat elektron tímto způsobem kvůli absenci d-podúrovně ve druhé úrovni. Dusík tedy nemůže být pětivazný, ale může tvořit čtvrtou kovalentní vazbu mechanismem donor-akceptor díky osamocenému elektronovému páru 2s2. Pro atom dusíku je také možný jiný proces. Když je jeden ze dvou elektronů 2s odstraněn, dusík se přemění na jednoduše nabitý čtyřmocný iont N+.

Od dusíku k vizmutu se atomové poloměry zvětšují a ionizační potenciály klesají. Redukční vlastnosti neutrálních atomů se zvyšují z N na Bi a oxidační vlastnosti slábnou (viz tabulka 21).
S vodíkem, dusíkem, fosforem a arsenem tvoří polární sloučeniny RH3, vykazující negativní oxidační stav -3. Molekuly RH3 mají pyramidální tvar. V těchto sloučeninách jsou vazby prvků s vodíkem pevnější než v odpovídajících sloučeninách prvků kyslíkové podskupiny a zejména halogenové podskupiny. Proto vodíkové sloučeniny prvků dusíkové podskupiny ve vodných roztocích netvoří vodíkové ionty.

S kyslíkem tvoří prvky dusíkové podskupiny oxidy obecného vzorce R2O3 a R2O5. Oxidy odpovídají kyselinám HRO2 a HRO3 (a orthokyselinám H3RO4, kromě dusíku). V rámci podskupiny se charakter oxidů mění následovně: N2O3 - kyselý oxid; Р4О6 - slabě kyselý oxid; As2O3 je amfoterní oxid s převládajícími kyselými vlastnostmi; Sb2O3 je amfoterní oxid s převahou bazických vlastností; Bi2O3 je hlavní oxid. Kyselé vlastnosti oxidů složení R2O3 a R2O5 tedy klesají s rostoucím atomovým číslem prvku.
Jak je vidět z tabulky. 21, v rámci podskupiny od dusíku po vizmut se nekovové vlastnosti snižují a kovové vlastnosti se zvyšují. U antimonu jsou tyto vlastnosti vyjádřeny stejně, u vizmutu převládají vlastnosti kovové a u dusíku nekovové. Fosfor, arsen a antimon tvoří několik alotropních sloučenin.
Dusík.
Účtenka
V laboratořích jej lze získat rozkladnou reakcí dusitanu amonného:
Reakce je exotermická, uvolňuje 80 kcal (335 kJ), takže nádoba musí být během jejího průběhu chlazena (ačkoli dusitan amonný musí být pro zahájení reakce zahřátý).
V praxi se tato reakce provádí přidáním nasyceného roztoku dusitanu sodného po kapkách do zahřátého nasyceného roztoku síranu amonného a dusitan amonný vzniklý jako výsledek výměnné reakce se okamžitě rozloží.
Uvolňovaný plyn je v tomto případě kontaminován čpavkem, oxidem dusíku (I) a kyslíkem, ze kterých se čistí postupným průchodem roztoky kyseliny sírové, síranu železnatého a přes horkou měď. Dusík se pak suší.
Další laboratorní metodou výroby dusíku je zahřívání směsi dichromanu draselného a síranu amonného (v hmotnostním poměru 2:1). Reakce probíhá podle rovnic:
Nejčistší dusík lze získat rozkladem azidů kovů:
Takzvaný „vzdušný“ nebo „atmosférický“ dusík, tedy směs dusíku s vzácnými plyny, se získává reakcí vzduchu s horkým koksem, čímž vzniká tzv. „generátor“ nebo „vzdušný“ plyn – surovina pro chemickou syntézu a palivo . V případě potřeby z něj lze dusík oddělit absorpcí oxidu uhelnatého.
Molekulární dusík se průmyslově vyrábí frakční destilací kapalného vzduchu. Tuto metodu lze také použít k získání „atmosférického dusíku“. Hojně se používají také dusíková zařízení a stanice, které využívají metodu adsorpce a membránové separace plynů.
Jednou z laboratorních metod je průchod amoniaku přes oxid měďnatý (II) při teplotě ~700 °C:
Amoniak se odebírá z nasyceného roztoku zahříváním. Množství CuO je 2x větší než vypočtené. Bezprostředně před použitím se dusík čistí od kyslíku a amoniaku průchodem přes měď a její oxid (II) (také ~700 °C), poté se suší koncentrovanou kyselinou sírovou a suchou alkálií. Proces je poměrně pomalý, ale stojí za to: získaný plyn je velmi čistý.
Schéma osnovy otevřené lekce na téma „PROTIhlavní podskupina skupiny"
Typ lekce : lekce osvojování nového materiálu
Cíle lekce : Organizace asimilace nových znalostí a aplikace dříve získaných dovedností a schopností
úkoly:
Vzdělávací : podporovat asimilaci nových znalostí na základě existujících znalostí. Formování dovedností a schopnostívypracujte schéma struktury atomu dusíku s uvedením počtu elektronů v elektronických vrstvách; určit charakteristické valenční a oxidační stavy dusíku;zvážit chemické vlastnosti dusíku ve světle oxidačního- redukční schopnosti atomu.
Vývojový : podporovat rozvoj samostatného myšlení, paměti a schopnosti porovnávat.
Vzdělávací : vytvářet podmínky pro utváření osobních vlastností, které zajišťují zodpovědnost a svědomitost studenta, jeho kritičnost a sebekritiku, aktivitu a pozornost při provádění myšlenkových procesů.
Metody : vysvětlovací-ilustrační, rozmnožovací, částečně rešeršní
Metodologie : metodika víceúrovňového a diferencovaného výcvikutechnika hledání analogie.
Didaktické materiály :
Referenční materiál:
Periodická tabulka prvků;
Tabulka elektronegativity;
Materiál na lekci
Učebnice
Prezentace
Leták
Technické prostředky :
Multimédia
Fáze lekce. Úkoly pro každou fázi lekce
Aktivita studentů
já.Organizování času
Připravil jsem vás na úspěšnou práci.
Podpora sebekontroly
Pozdrav studentů a hostů lekce. Označuji nepřítomné. Kontroluji vaši připravenost na lekci.
Pozdrav hostů a učitelů, příprava na lekci
IIAktualizace stávajících znalostí 1. Dovolte mi, abych vás přivedl k tématu lekce.
Na pozadí videa je popis látky na základě minulých zkušeností (přírodopis, 8. třída) bez uvedení jejího názvu
Dívají se, poslouchají. Po skončení videa navrhněte téma lekce
2. Stanovím si hlavní cíle lekce
Musí se naučit charakterizovat prvkyPROTIskupiny hlavní podskupiny
Musí znát základní mocenství dusíku
Musí znát základní oxidační stavy dusíku
Musí znát chemické a fyzikální vlastnosti dusíku
Zaznamenejte si téma lekce. Poslouchejte a analyzujte
3.Výběr diferencovaného cíle
První gól – žlutá vyžaduje pouze přenos znalostí, které se naučíte.
Druhý gól bude vyžadovat schopnost logického myšlení. Schopnost vysvětlit fakta naučená v hodině.
Třetí gól bude vyžadovat mobilizaci všech vašich znalostí a to nejen z chemie
Žlutý terč (základní čára) - A
Zelený cíl (pokročilý) - B
Červený cíl (pokročilá úroveň) - C
Umět charakterizovat prvky hlavní podskupiny, znát základní valenční a oxidační stavy dusíku. Znát fyzikální a chemické vlastnosti dusíku.
A + Umět vysvětlit změny
vlastnosti prvků v hl
podskupina. Umět vysvětlit redoxní vlastnosti dusíku.
B + Umět odhadnout vlastnosti
dusíku, zdůvodněte své závěry, aplikujte poznatky v praxi.
III.Učení nového materiálu
Rozvíjím dovednosti v práci s periodickým systémem D.I. Mendělejev, logické myšlení, schopnost srovnávat.
Pěstuji pozornost a přesnost
1.Práce s učebnicí a referenčním materiálem (periodická tabulka prvků). Odpověď na otázku. Otázky se zobrazují na obrazovce a čtou. Odpovědi jsou duplikovány na obrazovce pro ověření.
Odpovězte na otázku a zapište si do sešitů: 1. Jaké prvky jdou dovnitřPROTIskupina hlavní podskupina?.
2. Jak se mění vlastnosti prvků ve skupině vůči sobě navzájem shora dolů?
Psaní do sešitů. Odpovězte na otázku: 1. Jaká je struktura vnějšího elektronového obalu atomůPROTIhlavní podskupina skupiny? Student odpovídá na tabuli.
2. Jak jinak můžete nazvat prvky?PROTIskupiny hlavní podskupiny?
3. Proč se jaderný náboj prvků ve skupině zvyšuje z dusíku na vizmut?
4. Proč se poloměr atomů ve skupině zvětšuje z dusíku na vizmut?
Psaní do sešitů. Odpovězte na otázku: 1. Co spojuje všechny prvky této skupiny? Student odpovídá na tabuli.
2. Proč se atomová hmotnost prvků ve skupině zvyšuje z dusíku na vizmut?
3. Proč se zvyšují kovové vlastnosti prvků ve skupině od dusíku po vizmut?
4. Proč elektronegativita prvků ve skupině klesá z dusíku na vizmut?
Aktivace pozornosti, kognitivní činnost, zvědavost. Mezipředmětová komunikace
Krátká esej o objevu dusíku a jeho názvu
Nahrávejte do sešitů, poslouchejte.
Nahrávejte do sešitů, poslouchejte. Odpovědi na problematiku mocenství a oxidačního stavu dusíku
Nahrávejte do sešitů, poslouchejte. Reagujte na nejednotnost názvu a vlastností dusíku
Aktivace kognitivního zájmu.Rozvíjím dovednosti v práci s učebnicí,schopnost studentů samostatně získávat potřebné informace, vytvářením minimálních podmínek pro rozvoj individuálního pozorování, podporou rozvoje
2. Stanovení valencí a oxidačních stavů dusíku na základě grafického záznamu struktury vnějšího elektronového obalu
Psaní do sešitů
Pracujte u rady. Psaní do sešitů
Práce s učebnicí. Vysvětlování a záznam do sešitů
3.Primární konsolidace pokrývaného materiálu
Jaké prvky jsou zahrnutyPROTIA co skupina?
Jaká je základní valence dusíku?
Jaké jsou hlavní oxidační stavy dusíku?
Co znamená záznam?N -3 ?
Co znamená záznam?N +3 ?
Co znamená záznam?N 0 ?
Vytvořte sloučeniny, ve kterých bude dusík vykazovat oxidační stav
Vytvářím podmínky pro rozvoj paměti, podporuji rozvojschopnosti logického myšlení, schopnost srovnávat, schopnost vyvozovat závěry a zdůvodňovat je.
struktura molekuly jednoduché látky dusík.
Sborová odpověď povolena
Psaní do sešitů
Psaní do sešitů
Psaní do sešitů
Vytvářím podmínky pro rozvoj paměti, podporuji rozvojschopnosti logického myšlení, schopnost srovnávat, schopnost vyvozovat závěry a zdůvodňovat je.
Chemické vlastnosti dusíku
Dusík je oxidační činidlo.
Redukční činidlo dusíku
Psaní do sešitů
Psaní do sešitů
S jakými prvky bude dusík reagovat jako oxidační činidlo?
Psaní do sešitů
Hádejte, do jakých chemických reakcí dusík vstupuje?
Vytvářím podmínky pro rozvoj paměti (hodiny přírodopisu, opakování učiva 8. ročníku), podporuji rozvojlogické myšlení, schopnost srovnávat, vyvozovat závěry a zdůvodňovat je.
Fyzikální vlastnosti dusíku
Psaní do sešitů. Odpověď na otázku o fyzikálních vlastnostech dusíku na základě prověřených zkušeností a zkušeností
Psaní do sešitů
Psaní do sešitů
IV.Zajistěte materiál
Vytvářím podmínky pro rozvoj paměti, pro utváření osobních kvalit, které zajišťují zodpovědnost a svědomitost žáka, jeho kritičnost a sebekritiku. Přispívám k rozvojilogické myšlení, schopnost porovnávat.
Jak se dusík projevuje v chemických reakcích?
S čím dusík reaguje jako oxidační činidlo?
S čím dusík reaguje jako redukční činidlo?
Pomozte žlutému týmu s odpověďmi
Jakou roli hraje dusík ve vzduchu, považujeme-li vzduch za řešení?
PROTI. Shrnutí
Slova na rozloučenou. Vytváření podmínek pro sebehodnocení své práce v rocku
Kdo nasbíral tři žetony stejné barvy?
Kdo nasbíral více než tři žetony?
Kdo má žetony jiné barvy?
Napište své příjmení na zadní stranu svých žetonů a na konci hodiny je odevzdejte.
Žetony předávají po zazvonění lekce.
Žetony předávají po zazvonění lekce.
VI.Domácí práce
Vytvářím podmínky pro rozvoj kognitivní činnosti a paměti žáků
Budova se zobrazí na obrazovce
Záznam D/Z
§ 15 str. 52 č. 1
Odpovězte písemně na dvě otázky:
Co jsem se z tohoto tématu naučil?
Co bych chtěl vědět (jaká otázka nebyla ve třídě zodpovězena)?
Záznam D/Z
§ 15 str.52 č. 1 vytvořte 5slovnou křížovku na téma hodiny
Záznam D/Z
§ 15№1
Zapište pět reakcí přeměny dusíku
VII.Odraz
Určení emoční intenzity třídy po lekci
Strom "podzim-jaro"
Dekorace stromku "podzim-jaro"
Dekorace stromku "podzim-jaro"