Хімія елементів головної підгрупи 5 групи. Загальна характеристика елементів V А групи
До елементів V групи відносяться азот 7N, фосфор 15Р, Арсен 33Аs, сурма 51Sb і Бісмут 83Ві. За аналогією з галогенами і халькогенами для них запропоновано загальну назву “пніктогени” (у перекладі з грецької – задушливі, що мають неприємний запах, що особливо відноситься до водневих сполук цих елементів).
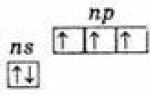
В основному стані атоми елементів V групи мають електронну конфігурацію зовнішнього шару ns2nр3, з трьома неспареними р-электронами. У ряді N – Р – Аs – Sb – Ві розміри атомів збільшуються, а енергії іонізації зменшуються, що призводить до посилення металевих властивостей: у вільному вигляді азот та фосфор – типові неметали, Арсен та сурма – металоїди, Бісмут – метал. Зі зростанням радіусу збільшуються і координаційні числа (КЧ) атомів. Для азоту характерні координаційні числа 1-4, для фосфору зазвичай реалізується КЧ = 4, але в з'єднаннях з галогенами КЧ може досягати 6, Арсен і сурма виявляють КЧ 4, 6, а вісмут - 7, 8, 9.
Внаслідок невеликого радіусу та високої електронегативності азот відрізняється від інших елементів своєї підгрупи. Відсутність у нього енергетично доступного вакантного d-підрівня призводить до того, що атом азоту може утворювати не більше чотирьох ковалентних зв'язків, у тому числі один зв'язок із донорно-акцепторним механізмом.
У зв'язку зі зростанням радіусу атома та зменшенням перекриття атомних р-орбіталей, міцність одинарних σ-зв'язків у ряді N-Р-Аs-Sb-Ви зменшується. Менша міцність зв'язку N-N у порівнянні зі зв'язком Р-Р обумовлена малим розміром атомів азоту і сильним міжелектронним відштовхуванням, що виникає внаслідок цього. Міцність кратних зв'язків, навпаки, зменшується зі зростанням розміру атомних орбіталей і, як наслідок, ослабленням їх перекриття з π-типу. Таким чином, найміцнішими виявляються кратні (потрійні) зв'язки для азоту. Для фосфору та миш'яку енергетично вигідніше утворення одинарних зв'язків.
Елементи V А групи виявляють різні ступені окислення. Для азоту характерний весь спектр від -3 до +5 (-3, -2, -1, +1, +2, +3, +4, +5). Для фосфору негативні ступені окислення менш характерними, ніж азоту. У той же час стійкість сполук з високим ступенем окиснення збільшується, що пов'язано із зменшенням електронегативності атома фосфору, зменшенням енергії іонізації та збільшенням міцності зв'язків. Арсен і сурма в сполуках мають ступеня окиснення -3, +3 і +5, а для вісмуту стійкими є сполуки зі ступенем окиснення +3.
Елементи V А групи у ступені окислення +3 зберігають нерозділену електронну пару, яка наводить їхню стехіометрію та донорні властивості.
Завдяки сумарній дії різних факторів (зростанню атомного радіусу, зменшенню рπ-рπ-перекриття, збільшенню ступеня екранування зовнішніх електронів) стійкість та окисювальна здатність сполук фосфору на наступних за ним елементів підгрупи змінюється немонотонно (вторинна періодичність) – найвищий ступінь окислення є найбільш стійким для фосфору. і сурми, в той же час з'єднання миш'яку і особливо вісмуту зі ступенем окиснення +5 часто є нестійкими або взагалі не існують. Сполуки вісмуту (V) – сильні окислювачі.
Для кисневих сполук фосфору й у меншою мірою для наступних елементів групи має місце рπ-dπ – перекриття, яке підвищує кратність зв'язку Е-О та збільшує його енергію. Тому сполуки фосфору практично не виявляють окисних властивостей, на відміну аналогічних сполук азоту.
4.2 Знаходження у природі
У вигляді простої речовини – азоту N2 – у природі знаходиться лише азот (його вміст у повітрі становить приблизно 78%). Вміст азоту у земній корі становить 2,5 · 10-3 мас.%. З природних мінералів промислове значення має чилійська (NaNO3) та калійна (КNO3) селітри.
Фосфор зустрічається у вигляді фосфатів, його вміст у земній корі становить 0,1 мас.%. Найбільш поширеними мінералами є апатити - гідроксоапатит Са5 (РО4) 3ОН, фторапатит Са5 (РО4) 2F, а також фосфорити Са3 (РО4) 2.
Арсен (1,5 · 10-4 мас.%), Сурма (2 · 10-5 мас.%), Бісмут (5 · 10-6 мас.%) Зустрічаються переважно у вигляді сульфідів – аурипігменту Аs2S3, антимоніту або стибійного блиску Sb2S3, бісмутового блиску Ві2S3, арсенопіриту FеАsS, тетрадиміту Ві2Те2S, а також оксигенвмісних сполук, наприклад, боронити FеАsО4 · 2Н2О, бісмутової охри Ві2О3 т.
4.3 Фізичні властивості та алотропія
За звичайних умов азот N2 – газ без кольору, запаху та смаку, розчинний у воді (2,3 мл/100 г Н2О при 0°C). Міцний внутрішньомолекулярний зв'язок, невеликий розмір та неполярність молекули N2 є причинами слабкої міжмолекулярної взаємодії, тому азот має низькі температури плавлення та кипіння (-2100С та -1960С відповідно).
Всі інші елементи групи V при кімнатній температурі – тверді речовини, що мають кілька алотропних модифікацій.
Для фосфору відомі три алотропні видозміни: білий, червоний та чорний.
Білий фосфор – м'яка кристалічна речовина, схожа на віск із неприємним часниковим запахом. Білий фосфор дуже отруйний, хімічно активний, легко самозаймається на повітрі, тому його зберігають під шаром води, в якій він практично не розчиняється. Добре розчиняється в сірковуглецю СS2 (якщо цим розчином зробити напис на стіні або змочити гніт свічки, то через деякий час, завдяки випаровуванню сірковуглецю, невидимий напис на стіні стане видимим, а свічка самозайметься). Білий фосфор має молекулярні ґрати, у вузлах яких знаходяться тетраедричні молекули Р4. Білий фосфор - сильна отрута, при нагріванні до 320оС без доступу повітря перетворюється на червоний фосфор.
Червоний фосфор, на відміну білого, не є отрутою, не розчиняється в сірковуглецю, не світиться у темряві. Червоний фосфор складається з угруповань Р8 і Р9, пов'язаних містками двох атомів фосфору. Червоний фосфор менш активний.
Чорний фосфор – найбільш стійка модифікація, що утворюється з білого з нагріву до 220°С та за дуже високого тиску (1200 атм.). На вигляд він нагадує графіт і є напівпровідником.
Арсен, сурма та вісмут, як і фосфор, існують у вигляді кількох модифікацій. Жовтий миш'як Аs4 за будовою нагадує білий фосфор. При зберіганні він самовільно перетворюється на стійкішу гексагональну форму, за будовою нагадує чорний фосфор. Вона є найбільш стійкою також для сурми та вісмуту.
Поряд від фосфору до вісмуту збільшуються координаційні числа, з'являється металевий блиск, зменшується крихкість і збільшується електропровідність.
4.4 Способи отримання простих речовин
У промисловості азот отримують фракціонування зрідженого повітря. Для цього повітря під високим тиском переводять у рідкий стан, а потім шляхом випаровування відокремлюють азот від менш легкого компонента - кисню (для азоту Ткіп. = -195,8оС, Для кисню Ткіп. = -183оС).
В лабораторії азот отримують термічним розкладанням амоній нітриту, літій азиду або нагріванням суміші розчинів нітриту натрію і амонію хлориду:
NH4NO2 → N2 + 2H2O;
2LіN3 → 3 N2 + 2Lі;
NаNO2 + NH4Сl → N2 + 2H2O + NаСl (азот, який утворюється в результаті цієї реакції може бути забруднений домішками азотної кислоти та оксид азоту, для видалення яких газ пропускають через підкислений розчин К2Сr2О7).
Фосфор у промисловості отримують прожарюванням суміші подрібненого фосфориту або апатиту з піском і вугіллям в електричних печах при температурі 15000С без доступу повітря:
Са3 (PO4) 2 + 3SiO2 + 5C → 3CaSiO3 + 2P + 5CO.
Фосфор виділяється у вигляді парів, які конденсуються у приймачі під водою у вигляді білого фосфору.
Крім фосфатів, можна відновлювати, наприклад, метафосфатну кислоту.
Арсен, сурма та вісмут отримують випалом сульфідних руд з подальшим відновленням оксиду коксом:
2 Е2S3 + 9 О2 → 6 SО2 + 2 Е2O3;
2 Е2О3 + 3 С → 2 Е + 3 СО.
4.5 Хімічні властивості простих сполук
Взаємодія з простими речовинами:
Молекулярний азот має дуже низьку реакційну здатність, що з наявністю в молекулі N2 потрійного зв'язку, а також неполярністю молекули. При кімнатній температурі азот реагує тільки з літієм, а при нагріванні з багатьма металами, наприклад, при 300оС:
3Mg + N2 → Mg3N2
магній нітрид
За температури електричної дуги (близько 3000оС) азот взаємодіє з киснем: N2 + O2 → 2NO.
При температурі 450оС, тиску 30 МПа, і в присутності каталізатора (Fe або Al2O3), азот реагує з воднем з утворенням аміаку:
N2 + 3H2 → 2NH3.
Реакційна здатність Р, Аs, Sb, Ві вища, ніж азоту. Так, при згорянні повітря фосфор утворює фосфатний ангідрид P2O5 (при нестачі кисню – P4O6):
4P + 5O2 → 2P2O5 – фосфор (V) оксид
Аs, Sb, Ві окислюються до триоксиду Е2О3.
Також інтенсивно протікає реакція з галогенами:
2Е + 3Cl2 → 2ЕCl3.
У надлишку хлору фосфор і сурма утворюють пентахлорид ЕCl5.
В результаті нагрівання з металами в інертній атмосфері Р, Аs, Sb, Ві утворюють фосфіди, арсеніди, Антимоніди та бісмутиди відповідно (стехіометричні та нестехіометричні), наприклад:
3Ca + 2P → Ca3P2 – кальцій фосфід.
4.6 Водневі сполуки елементів V А групи
Ступінь окислення -3
Всі елементи групи V утворюють з воднем сполуки ЕН3, але їх стійкість відрізняється. Стибін SbН3 та особливо бісмутин Він3 дуже нестабільні. При кімнатній температурі гідриди елементів V групи – гази без кольору з характерним різким запахом. Молекули ЕН3 мають форму тригональної піраміди.
Серед NH3 – РH3 – АsH3 – SbH3 – ВиH3 зі зростанням радіуса атома Е збільшується довжина зв'язку Е-Н. Одночасно зменшується перекриття орбіталей, що призводить до зниження міцності зв'язку Е-Н та стійкості молекул ЕН3. Реакція утворення гідриду є екзотермічною тільки для аміаку, але навіть він розкладається вже за температури 4000С. ВиH3 при температурі 250С існує лише протягом декількох хвилин.
Зв'язок N-Н дуже полярний, що пояснюється високою електронегативністю азоту, а також великим вкладом атомних орбіталей азоту в молекулярні орбіталі аміаку, великим сумарним дипольним моментом. Зменшення донорних властивостей незв'язувальної електронної пари призводить до того, що здатність до утворення іона ЕН4+ для фосфіну значно менша, а для арсину практично не існує.
Температури плавлення та кипіння у ряді NH3 – РH3 – АsH3 – SbH3 змінюються немонотонно. Високі температури фазових переходів NH3 пов'язані з наявністю водневих зв'язків відсутні у випадку інших гідридів. Зростання температур плавлення та кипіння при переході від РH3 до SbH3 пов'язане з посиленням міжмолекулярної взаємодії.
Видобуток: Взаємодіям простих речовин у промисловості одержують тільки аміак NH3 за реакцією:
N2 + 3H2 → 2NH3.
Промисловий синтез аміаку запровадив німецький хімік Ф. Габер і в 1918 отримав за це Нобелівську премію. Реакцію проводять при температурі 400-5000С та за підвищеного тиску (від 10 до 300 атм. Залежно від обладнання). Для прискорення реакції додають каталізатор – губчасте залізо із добавками калій, кальцій, магній, кремній оксидів.
В лабораторії аміак отримують при нагріванні за реакцією:
2NH4Cl + Ca (OH) 2 → CaCl2 + 2NH3 + 2H2O.
Фосфін РH3 (прозорий газ із запахом гнилої риби), як правило, одержують за реакціями:
4P + 3NaOH + 3H2O → PH3 + 3NaH2PO2;
Ca3P2 + 5HCl → 3CaCl2 + 2PH3.
Арсен гідрид або Арсиною AsH3 (прозорий, дуже отруйний газ із часниковим запахом) утворюється при відновленні сполук миш'яку:
As2O3 + 6Zn + 6H2SO4 → 2AsH3 + 6ZnSO4 + 3H2O
Трабзон є нестійким і при нагріванні розкладається на водень та вільний миш'як, який утворює на холодних частинах приладу чорний наліт (Арсена дзеркало), що є якісною реакцією на миш'як.
Для водневих сполук ЕН3 найбільш характерні реакції взаємодії з водою, реакції окислення та заміщення атома водню.
При переході від аміаку до фосфіну розчинність у воді та основні властивості різко зменшуються. Фосфін, Арсіною, стибін – малорозчинні у воді речовини. У водяних розчинах вони практично не виявляють основних властивостей. Фосфін в той же час є кислотою (але кислотні властивості дуже слабкі): активні метали заміщають у ньому один водень з утворенням фосфонідів МЕРН2.
Аміак, на відміну від гідридів інших пніктогенів, дуже добре розчиняється у воді (один обсяг води розчиняє 1200 обсягів NH3), це пояснюється утворенням водневих зв'язків та гідратів NH3 · nН2О різного складу. Аміак легко випаровується, тому навіть розбавлені розчини мають характерний запах.
Водний розчин аміаку виявляє властивості слабкої основи:
NH3 + Н2О ↔ NH4 + + OН-
Наявність вільної sp2-гібридної електронної пари наводить його донорні властивості – здатність взаємодіяти з кислотами з утворенням солей амонію, а також утворювати комплексні сполуки – аміакати:
NH3 + HCl → NH4Cl
NіСl2 + 6 NH3 → Cl2.
Солі амонію характеризуються низькою термічною стійкістю, розкладаються при нагріванні до різних продуктів, залежно від кислотного залишку.
Лужні метали при взаємодії з аміаком утворюють аміди:
NH3 + Nа → NаNH2 + ½ H2
Інші метали взаємодіють з аміаком з утворенням нітридів:
3Мg + 2NH3 → 3МgN3 + 3H2
Крім стехіометричних нітридів можливе утворення нестехіометричних сполук, наприклад, ТіN.
Фтор миттєво окислює аміак NF3. У присутності інших галогенів відбувається заміщення атомів водню, продукти реакції якого залежить від кислотності, температури, стійкості створюваних сполук.
Відновлювальні властивості:
Атоми елементів в ЕН3 знаходяться в нижчому ступені окислення, тому гідриди виявляють відновлювальні властивості.
На повітрі аміак не горить, але згоряє в атмосфері кисню:
- Без каталізатора: 4NH3 + 3O2 → 2N2 + 6H2O.
– З платиновим каталізатором: 4NH3 + 5O2 → 4NО + 6H2O.
Фосфін утворює з повітрям вибухонебезпечні суміші, а при підпалюванні згоряє з утворенням метафосфатної кислоти:
РH3+2O2 → НРО3+H2O.
Трабзон і стибін при згорянні утворюють триоксиду:
2 ЕH3 + 3 O2 → Е2О3 + 3H2O.
При підвищених температурах аміак здатний відновлювати деякі оксиди до металів:
2NH3+3CuO → 3Cu+N2+3H2O.
Фосфін, Арсіна і стибін сильнішими відновниками, вони відновлюють солі важких металів.
Солі амонію є стійкішими, ніж солі фосфонію. Вони можуть взаємодіяти з кислотами, лугами та іншими солями.
NH4Cl + HNO3 → NH4NO3 + HCl;
2NH4Cl + Ba (OH) 2 → 2NH3 + 2H2O + BaCl2;
(NH4) 2SO4 + BaCl2 → BaSO4 ↓ + 2NH4Cl.
Солі амонію, в яких аніон не є окислювачем, при нагріванні розкладаються:
NH4Cl ↔ NH3 + HCl
(NH4) 2SO4 ↔ 2NH3 + Н2SO4
Якщо аніон окислювач, то солі розкладаються остаточно:
NH4NO3 → N2O + 2H2O.
Фосфіди металів під дією води повністю гідролізують:
Mg3P2 + 6H2O → 3Mg (OH) 2 + 2PH3 .
Крім аміаку, азот утворює інші сполуки з воднем, наприклад, гідразин N2H4 (ступінь окислення азоту 2). Гідразин – рідина з різким запахом, подібно до аміаку здатна до іонізації, слабша основа, ніж аміак, дуже сильний відновник. НN3 - азотистоводнева кислота (формальний ступінь окислення азоту -1/3 - НNN2, один атом азоту має ступінь окислення +5, інший -3) - рідина без кольору, з різким запахом, вибухонебезпечна. Дуже сильний відновник, сильна кислота.
4.7 оксигенвмісних сполук елементів V А групи
Оксигенвмісних сполук азоту
Нітроґен із киснем утворює шість оксидів: N2O, NO, N2O3, NO2, N2O4, N2O5 (крім того, відомі ще два нестійкі оксиди N4O, NO3). Перші два оксиди несолетворні. Інші при взаємодії з водою утворюють відповідні кислоти – нітритну та нітратну.
Всі оксиди азоту можна отримати при взаємодії металів різної активності з азотною кислотою або розкладання нітратів при температурі. Тільки NО можна отримати прямим синтезом із простих речовин за високих температур (він також утворюється в атмосфері при грозових розрядах).
Ступінь окислення +1:
Нітроґен (I) оксид, N2O – прозорий газ без запаху, із солодким присмаком, розчинний у воді. При вдиханні у значних кількостях збуджує нервову систему, тому має ще назву "веселячий газ".
Отримують N2O за розкладанням при 200oC амоній нітрату:
NH4NO3 → N2O + 2H2O.
З водою, кислотами та лугами N2O не реагує. Має окислювальні властивості, але при взаємодії з сильними окислювачами поводиться як відновник:
2N2О + 6Сl2 → 4NСl3 + O2.
Ступінь окислення +2:
Нітроґен (II) оксид, NO – прозорий газ, розчиняється у воді, але не реагує з нею.
У лабораторії його отримують за реакцією:
3Cu + 8HNO3 → 3Cu (NO3) 2 + 2NO + 4H2O.
У промисловості NО отримують каталітичним окисленням NH3 на платино-родієвому каталізаторі при 700 oC:
4NH3 + 5O2 → 4 NO + 6H2O.
У реакціях NO, як правило, виявляє відновлювальні властивості – знебарвлює розчин КМnO4, легко окислюється киснем:
2NO + O2 → 2NO2.
Але може бути і окислювачем:
2NO + 2H2 → N2 + 2H2O.
Ступінь окислення +3:
Нітроґен (iii) оксид, N2O3 – темно-синя рідина (одночасно існує також у газоподібному та твердому стані). Вже за низьких температур розкладається на NO і NO2:
N2O3 → NO + NO2.
З водою N2O3 утворює азотисту кислоту: N2O3 + Н2О → 2НNO2.
HNO2 – слабка, нестійка кислота, виявляє окислювально-відновну двоїстість, існує тільки в розведених розчинах, з підвищенням температури розкладається:
3HNO2 → HNO3 + 2NO + H2O.
Ступінь окислення +4:
Нітроґен (IV) оксид, NO2 – газ бурого кольору з характерним запахом, добре розчинний у воді. NO2 димеризується при охолодженні з утворенням безбарвної рідини N2O4.
Отримати його можна при дії на мідь концентрованої азотної кислоти або розкладанням при нагріванні нітратів металів, які знаходяться в ряді напруги від магнію до міді:
Cu + 4HNO3 → Cu (NO3) 2 + 2NO2 + 2H2O;
2Pb (NO3) 2 → 2PbO + 4NO2 + O2 .
Взаємодія NO2 з водою можна записати так:
6NO2 + 2H2O → 4HNO3 + 2NO.
NO здатний окислюватися киснем повітря, тому єдиним продуктом взаємодії NO2 з водою у присутності надлишку повітря є азотна кислота
4NO2 + O2 + 2H2O → 4HNO3.
Ця реакція використовується для отримання азотної кислоти у промисловості.
NO2 - сильний відновник, в атмосфері якого згоряє сірка, вуглець, багато металів. Його можна вважати змішаним ангідридом азотної та азотистої кислот, так як при розчиненні у воді він утворює суміш цих кислот:
2NO2 + H2O → HNO2 + HNO3
Нітритна азотна
кислота кислота
Ступінь окислення +5:
Нітроґен (V) оксид або азотний ангідрид, N2O5 – біла тверда кристалічна речовина, сильний окислювач, виявляє кислотні властивості: у результаті розчинення у воді утворює азотну кислоту, з лугами утворює солі азотної кислоти – нітрати.
Отримати N2O5 можна за реакцією:
2HNO3 + P2O5 → 2HPO3 + N2O5;
При нагріванні розкладається за рівнянням:
2N2O5 → 4NO2 + O2.
HNO3 - азотна або азотна кислота - летюча безбарвна рідина з різким запахом, змішується з водою в будь-яких відносинах, Тпл = -420С, Ткіп = 830С.
При температурі розкладається з виділенням NO2, який забарвлює її у жовтий колір:
4HNO3 → 4NO2 + O2 + 2H2O.
Вперше азотну кислоту отримав У.Ф. Глаубер під впливом сірчаної кислоти на селітру. Зараз цей спосіб застосовують у лабораторії для одержання азотної кислоти: NaNO3 + H2SO4 → NaHSO4 + HNO3.
У промисловості застосовується аміачний спосіб одержання азотної кислоти: 4NH3 + 5O2 4NO + 6H2O
4NO + 2O2 → 4NO2
4NO2 + O2 + 2H2O 4HNO3
Аміачний спосіб дозволяє одержати 50% азотну кислоту. 98% HNO3 отримують перегонкою 50% азотної кислоти у присутності H2SO4. Також азотної кислоти одержують дуговим способом, перша стадія цього процесу - утворення NO з простих речовин при 30000С.
Азотна кислота – сильний електроліт та сильний окислювач, тому деякі метали при дії азотної кислоти пасивуються, інші відновлюють нітроґен азотної кислоти у різних ступенях окислення (залежно від природи відновника та концентрації кислоти), але ніколи метали не витісняють водень із розчинів азотної кислоти.
Концентрована азотна кислота має найбільш сильні окисні властивості:
з лужними та лужноземельними металами Na, Ca, Ba, Мg вона відновлюється до N2O, наприклад:
Mg + 10HNO3 (конц.) → 4Мg (NO3) 2 + N2O + 5H2O
з важкими металами Cu, Ag, Hg відновлюється до NO2, наприклад:
Cu + 4HNO3 (конц.) → Cu (NO3) 2 + 2NO2 + 2H2O
з Fe, Сr, Al, Au, Pt – не взаємодіє.
Розведена азотна кислота
з лужними, лужноземельними металами та Fe відновлюється до NH3 (NH4NO3), наприклад:
4Mg + 10HNO3 (розбій.) → 4Mg (NO3) 2 + NH4NO3 + 5H2O
– З важкими металами Cu, Ag, Hg відновлюється до NO, наприклад:
3Cu + 8HNO3 (розбій.) → 3Cu (NO3) 2 + 2NO + 4H2O
При взаємодії неметалів (C, S, P, Si) із концентрованою азотною кислотою азот відновлюється до NO2, а з розведеною – до NO, наприклад:
5HNO3 (конц.) + Р → Н3РО4 + 5NO2 + H2O;
5HNO3 (розбій.) + 3Р + 2Н2О → 3Н3PO4 + 5NO.
Суміш, що складається з 1 об'єму концентрованої азотної кислоти та 3 об'ємів концентрованої соляної кислоти, називається "міцна (королівська, князівська) вода", "царська горілка". У цій суміші розчиняються навіть шляхетні метали, які з азотною кислотою не взаємодіють (це пояснюється утворенням дуже сильного, нестійкого окислювача NOCl – нітрозилхлориду).
Au + HNO3 + 4HCl → H + NO + 2H2O
3Pt + 4HNO3 + 18HCl → 3H2 + 4NO2 + 8H2O
Солі азотної кислоти - нітрати, добре розчиняються у воді, при нагріванні розкладаються з виділенням кисню:
нітрати лужних та лужноземельних металів розкладаються до нітритів:
2NaNO3 → 2NaNO2 + O2;
нітрати металів, що стоять у ряді напруг від Mg до Cu, розкладаються до оксиду металу: 2Pb (NO3) → 2PbO + 4NO2 + O2;
нітрати найменш активних металів (срібла, золота, платини) розкладаються при нагріванні до вільного металу:
2AgNO3 → 2Ag + 2NO2 + O2.
Оксигенвмісних сполук фосфору, миш'яку, сурми та вісмуту
Ступінь окислення +3
Оксиди Е2O3 одержують при взаємодії простих речовин із киснем. Однак якщо у випадку з Аs, Sb, Ві оксиди утворюються навіть при надлишку кисню, процес окислення фосфору необхідно строго контролювати. Фосфор (iii) оксид P2O3 (за наявності нерозділеної електронної пари існує у вигляді димеру P4O6). P4O6 - біла пухка кристалічна речовина (Ткіп. = 174оС, Тпл. = 24оС), утворюється при повільному окисленні фосфору при 50 ° С і 90 мм
У інтервалі температур 20-50оС він окислюється киснем повітря (у присутності слідів фосфору – мимоволі):
Р4О6 + 2О2 → Р4О10, цей процес супроводжується хемілюменісценцією та є причиною свічення білого фосфору.
З водою утворює триоксофосфатну (V) кислоту:
Р4О6 + 6Н2О → 4Н3РО3
Відповідно до структурної формули ця кислота є двоосновною:
Утворюється при взаємодії фосфору трихлориду з водою:
PCl3 + 3H2O → 3HCl + H3PO3.
У вільному стані H3PO3 – безбарвна кристалічна речовина, добре розчинна у воді та спирті. Є досить сильним відновником (сильніший відновник, ніж азотна кислота), відновлює метали з їх солей.
У групі зверху донизу кислотний характер оксидів замінюється на основний:
Арсен (iii) оксиду або арсенистому ангідриду As2O3 відповідає миш'як (iii) гідроксид – амфотерний гідроксид, у якого превалюють кислотні властивості:
As2O3 + 3H2O → 2As (ОH) 3 ↔ 2 H3AsO3.
H3AsO3 – гідроґен триоксоарсенат (iii) існує лише у водному розчині. Солі цієї кислоти називаються арсеніти, їх можна отримати за реакцією:
As2O3 + 6КОH → 2К3AsО3 + 3H2O
калій арсеніт
З'єднання миш'яку (iii) мають відновлювальні властивості, внаслідок їхнього окислення утворюються сполуки миш'яку (V).
Sb2O3 – сурма (iii) оксид або стибатний ангідрид – амфотерний оксид: Sb2O3 + 3H2SO4 → Sb2 (SO4) 3 + 3H2O;
Sb2O3 + 3NaOH → 2NaSbO2 + H2O
Ви2О3 – основний оксид, розчиняється у кислотах із заснуванням солей вісмуту. Вісмут (iii) гідроксид, Ві (ОН) 3 – дуже слабка основа, тому солі вісмуту (iii) гідроліз з утворенням малорозчинних основних солей. Під час гідролізу Bi (NO3) 2 часто утворюється оксосиль:
Bi (NO3) 2 + H2O → BiОNO3 + 2НNO3.
Ступінь окиснення +5
Фосфор (V) оксид – Р2О5 (фосфорний ангідрид) – білий пухкий порошок, що розпливається на повітрі. Гексагональна модифікація, яка утворюється при згорянні фосфору надлишку кисню, побудована з молекул Р4О10. Енергійно взаємодіє з водою з утворенням складної суміші, що складається з метафосфатних кислот, які при кип'ятінні гідролізуються до ортофосфорної кислоти. Реакція супроводжується сильним розігрівом:
ПІДІЛИТИСЯ:
ns 2 np 3.
АЗОТ та його з'єднання
У природі зустрічається у вільному вигляді (зміст у повітрі – 78 об'ємних %), у вигляді мінералів (селітри), у нафті, у рослинних та тваринних білках.
Фізичні властивості
За звичайних умов N 2 – газ без кольору, запаху та смаку,
t o кіп. = -195,8 про З.
Отримання азоту:
а) у промисловості – зрідженням повітря,
б) у лабораторії: NH 4 NO 2 ® N 2 + Н 2 О.
Хімічні властивості азоту та його сполук.
Хімічна активність молекулярного азоту дуже мала, т.к. завдяки потрійному ковалентному зв'язку молекула дуже міцна (Е зв'язку = 946 кДж/моль). Однак відомо багато різних сполук для азоту, в яких він виявляє ступеня окиснення -3, -2, -1, +1, +2, +3, +4, +5.
З'єднання азоту з негативними ступенями окиснення.
3
1)NH 3 – аміак– безбарвний газ із різким запахом, легко зріджується.
Отримання аміаку:
а) N 2 + 3H 2 « 2NH 3 (Kat: Fe, Al 2 O 3 , K 2 O)
б) 2NH 4 CI + Ca(OH) 2 = CaCI 2 + 2NH 3 + 2H 2 O
Хімічні властивості аміаку:
а) NH 3 + H 2 O NH 4 OH (максимальна концентрація = 25%)
б) NH 3 + HCI NH 4 CI (дон.-акц. Механізм: NH 3 + Н + = NH 4 +)
в)горіння в залежності від кількості кисню йде по-різному:
4NH 3 + 3О 2(тиж.) = 2N 2 + 6H 2 O
4NH 3 + 5О 2(ізб.) = 2NО+ 6H 2 O
г) в ОВР аміак завжди відновник:
3CuO + 2NH 3 = 3Cu + N 2 + 3H 2 O
2) NH 4 OH – гідроксид амонію- слабка основа, нестійка, добре утворює комплексні сполуки (аміакати):
Cu(OH) 2 + 4NH 4 OH = (OH) 2 + 4H 2 O
3) Солі амонію:
а) розчини внаслідок гідролізу мають слабокислу реакцію:
NH 4 CI + НОН « NH 4 ВІН + НCI (NH 4 + + НОН « NH 4 ВІН + Н +)
б) термічне розкладання солей амонію йде по-різному залежно від природи аніону: якщо аніон – окислювач, то реакція розкладання йде необоротно:
NH 4 CI « NH 3 + HCI
NH 4 NO 3 = N 2 Про+ 2H 2 O
4) Амідиутворюються при заміщенні атомів Н в аміаку на метал:
2К + 2NH 3 = 2КNH 2 + H 2
5) Нітрідивідомі для металів та неметалів і залежно від природи по-різному розкладаються:
а) Li 3 N + 3H 2 O = 3LiOH + NH 3
Ca 3 N 2 + 6HCI = 3CaCI 2 + 2NH 3
б) CI 3 N + 6HCI = 3HCIO + NH 3
Ступінь окислення - 2
N 2 Н 4 – гідразин(Діамід) - безбарвна рідина, хороший розчинник, менш стійкий, ніж аміак.
Отримання гідразину:
2NH 3 + NaCIO = N 2 Н 4 + NaCI + H 2 O
Хімічні властивості гідразину:
N 2 Н 4 + H 2 O + OH -
H 2 O « 2+ +OH -
б) Згоряє до азоту: N 2 Н 4 + O 2 = N 2 + 2H 2 O
в) Сильний відновник: N 2 Н 4 + 2H 2 O 2 = N 2 + 4H 2 O
Ступінь окислення - 1
NH 2 OH – гідроксиламінбіла кристалічна речовина, займає проміжне положення між H 2 O 2 і гідразином N 2 Н 4.
Отримання гідроксиламіну:
HNO 3 + 6Н = NН 2 ВІН + 2H 2 O
Хімічні властивості гідроксиламіну:
а) Водні розчини – слабкі основи:
NН 2 ВІН + H 2 O « + + OH -
б) З кислотами дають солі гідроксиламонію (стійкі):
NН 2 ВІН + HCI = + + CI -
в) Розкладається (реакція диспропорціонування):
3NН 2 ВІН = NН 3 + N 2 + 3H 2 O
г) Як і H 2 O 2 залежно від середовища проявляє окислювально-відновну двоїстість:
ок-ль: 2NН 2 ВІН + 4FeSO 4 + 3H 2 SO 4 = 2Fe 2 (SO 4) 3 + (NH 4) 2 SO 4 + 2H 2 O
восст-ль: 2NН 2 ВІН + I 2 + 2KOH = N 2 + 2KI + 4H 2 O
Найбільш важливі сполуки азоту з позитивними с. о.
Ступінь окислення + 3
1) N 2 Про 3- оксид азоту (III) або «азотистий ангідрид» - нестійка синьо-зелена рідина:
а) N 2 Про 3 ® NО 2(бурий газ з різким запахом) + NО (безбарвний газ);
б) з водою утворює нестійку кислоту: N 2 Про 3 + H 2 O « 2 HNO 2
2) HNO 2- азотиста кислота (середньої сили):
HNO 2 « H + + NO 2 - (К = 5,1 . 10 -4).
3) Нітріти- солі азотистої кислоти, як і інші сполуки N +3 в окислювально-відновних реакціях, виявляють подвійність:
ок-ль:КNO 2 + NH 3 = N 2 + H 2 O
восст-ль:КNO 2 + H 2 O 2 = КNO 3 + H 2 O
Максимальний ступінь окислення + 5
1) N 2 Про 5- оксид азоту (V) або «азотний ангідрид» - безбарвна кристалічна речовина; при розчиненні у питній воді дає кислоту.
2) HNO 3- азотна кислота, сильна: HNO 3 ® H + + NO 3 - .
3) Нітрати- Солі азотної кислоти:
а) в лабораторії можна отримувати N 2 Про реакції термічного розкладання: NH 4 NO 3 ® N 2 О + Н 2 О;
б) нітрати металів залежно від положення металу у ряді активності розкладаються по-різному:
ліворуч Mg:нітрат ® нітрит + O 2
Mg – Cu:нітрат ® оксид металу + NO 2 + O 2
правіше Cu:нітрат ® метал + NO 2 + O 2 .
4) все сполуки N +5 сильні окислювачі; взаємодія азотної кислоти з металами:
а) жоден метал не виділяє з HNO3 водень;
б) при звичайній t o пасивуються метали Al, Zn, Cr, Fe, Pb, Au, Pt;
в) при нагріванні з більшістю металів взаємодіє, причому чим активніший метал і розбавленіша кислота, тим сильніше восст-ся N +5:
неакту. Ме: Cu + 4HNO 3(конц.) = Cu(NO 3) 2 + 2NO 2 + 2H 2 O
3Cu + 8HNO 3(розб.) = 3Cu(NO 3) 2 + 2NO + 4H 2 O
актив. Ме: 4Cа + 10HNO 3(конц.) = 4Cа(NO 3) 2 + N 2 Про + 5H 2 O
5Cа + 12HNO 3(розб.) = 5Cа(NO 3) 2 + N 2 + 6H 2 O
4Cа + 9HNO 3 (оч. розб.) = 4Cа(NO 3) 2 + NН 3 (або NH 4 NO 3)+ 3H 2 O
ФОСФОР та його сполуки
У природі зустрічається: а) у вигляді мінералів (фосфорити та апатити), б) у рослинних та тваринних білках, в) у тканинах мозку та кістках.
Фізичні властивості
Алотропен:
а) білий фосфор(Р 4) – тетраедрична будова, отруйна, світиться у темряві, розчинний у сірковуглецю; при зберіганні поступово перетворюється на червоний фосфор, тому його зберігають під водою;
б) червоний фосфор(Р 2 n – полімер) – існує кілька форм будови, що не отруйний, нерозчинний у сірковуглецю, стійкий при зберіганні, менш реакціоноспроможний;
в) чорний фосфор- Пірамідальна будова, шаруватий, схожий на графіт, напівпровідник.
Отримання фосфору:
Мінерал «фосфорит» прожарюють з коксом та піском:
Са 3 (РО 4) + 5С + 3 SiО 2 = 3СаSiО 3 +2Р +5СО
Хімічні властивості фосфору та його сполук.
Хімічна активність фосфору різна залежно від його аллотропної модифікації. Основні ступені окислення: -3, +1, +3, +5.
1) Реакції фосфору із простими речовинами:
відновлювальні властивості: a) Р + О 2 ® Р 2 О 3, Р 2 О 5;
б) Р + СI 2 ® РCI 3, РCI 5; в) 2Р + 3S ® Р 2 S 3
окисні властивості:а) 2Р + 3Н 2 ® 2РН 3, б) 2Р + 3Са ® Са 3 Р 2
2) Реакції фосфору зі складними речовинами:
а) реакція з водою не йде,
б) 2Р + 5H 2 SO 4(конц.) ® 2H 3 РO 4 + 5SO 2 + 2H 2 O,
в) Р + HNO 3 (конц.) H 3 Р 4 + NO (або NO 2).
3)Мінімальний ступінь окислення - 3
а) РН 3– фосфін, отруйний газ із часниковим запахом,
горить: 2РH 3 + 4О 2 = Р 2 О 5 + 3H 2 O,
з деякими кислотами дає солі фосфонію: РH 3 + HI = РH 4 I
б) фосфіди металів– іоноковалентні сполуки
Mg 3 P 2 + 6 H 2 O = Mg(ОН) 2 + 2РН 3 ,
Са 3 P 2 + 6HСI = CaCI 2 + 2РН 3 .
4)Ступінь окислення + 1
H 3 РO 2 або Н[РO 2 H 2 ] - фосфорнувата кислота, сильна; солі - гіпофосфіти, добре розчиняються, хороші відновники.
5)Ступінь окислення + 3
а) Р 2 Про 3 - фосфористий ангідрид, має кілька модифікацій (Р 2 Про 3) n безбарвні отруйні кристали;
б) H 3 РO 3 або H 2 [РO 3 Н] - фосфориста кислота середньої сили;
в) солі фосфіти, розчинні тільки у лужних металів (К 2 [РO 3 Н]),
РСI 3 + CI 2 = PCI 5
РСI 3 + О 2 = PОCI 3
РСI 3 + НCI ® Н.
6)Максимальний ступінь окислення +5
а) Р 2 О 5 - фосфорний ангідрид, білий порошок, має модифікацію (Р 2 О 5) 2 , сильний водовіднімний засіб: Р 2 О 5 + 2H 2 O = 2HРO 3;
б) HРO 3 - мета, H 4 Р 2 O 7 -піро, H 3 РO 4 -ортофосфорна кислота, середньої сили;
в) солі мета-, піро-, орто-фосфати;
г) галогеніди досить активні:
РСI 5 + 4H 2 O = H 3 Р0 4 +5НСI ,
РF5+HF=Н.
ЗАГАЛЬНА ХАРАКТЕРИСТИКА ПІДГРУПИ
7 N, 15 P, 33 As, 51 Sb, 83 Bi. По підгрупі зверху вниз металеві властивості закономірно збільшуються і це узгоджується зі значеннями ступенів окислення, що виявляються елементами сполук, а також з деякими фізичними властивостями. Хоча алотропія P, As і Sb створюють певні труднощі при зведенні фізичних властивостей до єдиної таблиці:
Таблиця 11
Властивості елементів п'ятої групи, головної підгрупи
Хімічні властивості
1. З простими речовинами дають різні сполуки, проявляючи різну окислювально-відновну природу:
а) відновлювальні властивості
2P + 3Cl 2 = 2PCl 3 (або PCl 5);
4As + 5O 2 = 2As 2 O 5;
2Bi + 3Cl 2 = 2BiCl 3 .
б) Окислювальні властивості
2P + 3Ca = Ca 3 P 2;
2As + 3Mg = Mg 3 As 2 .
2. З кислотами реагують по-різному, залежно від природи елемента підгрупи:
2P + 5H 2 SO 4 = 2H 3 PO 4 + 5SO 2 + 2H 2 O;
3As + 5HNO 3 + 2H 2 O = 3H 3 AsO 4 + 5NO;
3Sb + 5HNO 3 = 3HSbO 3 + 5NO + H 2 O;
2Sb + 6Н 2 SO 4 конц. = Sb 2 (SO 4) 3 + 3SO 2 + 6H 2 O;
Bi + 4HNO 3 = Bi(NO 3) 3 + NO + 2H2O.
Необхідно пам'ятати, що елементи підгрупи миш'яку серед активності стоять після водню.
3. Гідроліз сполук йде по-різному:
а) PCl 3 + 3H 2 O = H 3 PO 3 + 3HCl;
BiCl 3 + H 2 O ® BiOCl + 2HCl.
(SbCl 3) (SbOCl)
б) NaNO 2 + H 2 O HNO 2 + NaOH;
K 3 PO 4 + H 2 O K 2 HPO 4 + KOH;
K 3 AsO 4 + H 2 O K 2 HAsO 4 + KOH.
4. Зміна кислотно-основних властивостей у елементів проявляється по-різному
Таблиця 12
Найбільш важливі сполуки елементів п'ятої підгрупи
5. Окисно-відновна здатність сполук залежить від ступеня окиснення елемента:
а) Е-3– відновники
2NH 3 + 6KМnO 4 + 6KOH = 6K 2 MnO 4 + N 2 + 6H 2 O;
2PH 3 + 4O 2 = P 2 O 5 + 3H 2 O.
окислювачі:
2KNO 2 + 4H 2 S = 3S + N 2 + K 2 S + 4H 2 O
Е +3 2BiCl 3 + 3SnCl 2 + 18KOH = 2Bi + 3K 2 SnO 3 + 12KCl + 9H 2 O.
відновники:
10KNO 2 +4KМnO 4 +11H 2 SO 4 =10HNO 3 +4MnSO 4 +7K 2 SO 4 +6H 2 O
в) Е +5 – окислювачі
Na 3 SbO 4 + 2NaJ + H 2 SO 4 = Na 3 SbO 3 + J 2 + Na 2 SO 4 + H 2 O.
Елементи 6-ї групи. (Халькогени)
Будова електронної оболонки: … ns 2 np 4.
8 O, 16 S, 34 Se, 52 Te, 84 Po(радіоактивний).
КИСНЕД та його сполуки
Найпоширеніший елемент Землі: 21% (об'ємних) повітря, входить до складу Н 2 Про, мінералів, органічних речовин.
Фізичні властивості
Існує у вигляді речовин:
а) «кисень» Про 2 - газ без кольору, смаку, запаху, не отруйний, ; t° кіп. = -183 ° С; ;
б) «озон» О 3 – блакитний газ із різким запахом, отруйний, дуже сильний окислювач; t° кіп. = -111,8 ° С.
Хімічні властивості
1. Тільки в одній реакції кисень є відновником:
Про 2 + 2F 2 = 2OF 2 ().
2. У решті випадків кисень – окислювач, особливо якщо він знаходиться в атомарному стані:
а) Окислення простих речовин
2Н2 + О2 = 2Н2О;
S + O 2 = SO 2;
2 Ca + O 2 = 2 CaO.
б) Окислення складних речовин
Р 2 О 3 + О 2 = Р 2 О 5;
2SO 2 + O 2 = 2SO 3;
2PCl 3 + O 2 = 2POCl 3 .
в) Горіння складних неорганічних речовин
2H 2 S + O 2 недост. = 2S + 2H2O;
2H 2 S + 3O 2 хат. = 2SO2 + 2H2O.
г) Горіння органічних речовин
СН 4 + 2О 2 = СО 2 + 2Н 2 О;
З 2 Н 5 ВІН + 3О2 = 2СО2 + 3Н2О.
СЕРА та її сполуки
У природі зустрічається у самородному вигляді; у вигляді мінералів (сульфіди, сульфати); у нафті; у білках.
Фізичні властивості
Тверда, тендітна, жовтого кольору, не розчинна в Н 2 Про, але розчинна в сірковуглецю, аніліну. Алотропна: ромбічна сірка (a-форма); моноклінна (b - сірка); пластична та ін. Найбільш стійка модифікація a (t ° пл. » 113 ° С), їй приписують склад S 8 .
Хімічні властивості
Сполуки, виявляючи різні ступені окислення, мають різну окислювально-відновну здатність.
Таблиця 13
Найбільш важливі сполуки сірки
1. Сірка, взаємодіючи зі складними сполуками, по-різному змінює свій рівень окислення:
а) S + 2H 2 SO 4 конц. = 3SO 2 + 2H 2 O();
б) S + 6HNO 3 конц. = H 2 SO 4 + 6NO 2 + 2H 2 O();
в) 3S + 6NaOH = 2Na 2 S + Na 2 SO 3 + 3H 2 O
реакція диспропорціонування
2. З'єднання S-2
а) H 2 S– сірководень, отруйний газ із запахом тухлих яєць, сильний відновник: 2H 2 S + O 2 = 2S + 2H 2 O;
H 2 S + Cl 2 = 2HCl + S.
б) Розчин Н2S – слабка кислота
Н 2 S N + + HS - (К 1 = 6 × 10 -8).
в) Солі – сульфіди; солі лужних і лужноземельних металів добре розчиняються, гідролізуються; сульфіди р-, d-металів практично не розчиняються.
г) Сульфідиметалів виявляють основнуприроду:
K 2 S + H 2 O KHS + KOH;
Сульфіди неметалів виявляють кислотнуприроду:
SiS2+3H2O=H2SiO3+2H2S.
д) Тіосолі: схожі на звичайні солі, в яких атоми замінені на S:
Na 2 S + CS 2 = Na 2 CS 3 - тіокарбонат натрію;
Na 2 CS 3 + 2HCl = 2NaCl + H 2 CS 3
нестійка
е) Полісульфіди: сірка, подібно до кисню в перекисах, може утворювати солі: Na 2 S розчин + 'S = Na 2 S n - полісульфід натрію (містять сульфідні містки - S - S - S - S -).
3. З'єднання S+4
а) SO 2 – сірчистий газ із різким запахом, отруйний;
б) Розчин SO 2 – сірчиста кислота H 2 SO 3 середньої сили
H 2 SO 3 N + + HSO 3 - (К 1 = 1,3 × 10 -2);
в) Солі - сульфіти, добре гідролізуються
Na 2 SO 3 + H 2 O NaHSO 3 + NaOH.
г) В окислювально-відновних реакціях всі ці сполуки виявляють подвійність:
SO 2 + 2H 2 S = 3S + 2H 2 O;
2SO 2 + O 2 = 2SO 3 .
д) хлористий тіоніл: SOCl 2
SOCl 2 + 2H 2 O = H 2 SO 3 + 2HCl.
4. З'єднання S+6
а) SO 3– сірчаний ангідрид; Алотропен, сильний окислювач. Дуже енергійно реагує із водою
SO 3 + H 2 O ® H 2 SO 4 + 89,1 кДж/моль;
б) H 2 SO 4– сірчана кислота, безбарвна масляниста рідина; сильна.
H 2 SO 4 конц. - Дуже сильний окислювач; обглинає папір, цукор, дерево:
+ 2H 2 SO 4 конц. = 2 +2SО 2 + 2H 2 O.
Індивідуально її поведінка з металами:
при звичайній температурі з багатьма металами не взаємодіє («пасивує» Cr, Fe, Al, Zn, …);
при підвищеній реагує майже з усіма металами, крім Au та Pt.
Є дуже добрим водовіднімним засобом, т.к. з водою утворює гідрати H 2 SO 4 × nH 2 O:
в) Солі: середні - K 2 SO 4 (сульфати);
кислі - KHSO 4 (гідросульфати);
купороси - CuSO 4 × 5H 2 O; ZnSO 4 × 7H 2 O;
галун - подвійні солі, кристалогідрати
KAl(SO 4) 2 × 12H 2 O; NH 4 Fe(SO 4) 2 × 12H 2 O.
г) Олеум- розчин SO 3 в H 2 SO 4 при цьому частково йде реакція
2SO 3 + H 2 O = H 2 S 2 O 7 піросерна кислота.
д) Хлористий сульфурил SO 2 Cl 2
SO 2 Cl 2 + 2H 2 O = H 2 SO 4 + 2HCl.
е) Пероксосерні кислоти– містять перекисні містки
H 2 SO 5 – пероксомоносерна,
H 2 S 2 O 8 - пероксодісерна;
сильні окисники.
ж) Тіосульфати- містять сірку в різних ступенях окиснення: S +6 і S -2; завдяки наявності S-2 з'єднання є сильними відновниками.
Na 2 S 2 O 3 + Br 2 + H 2 O = 2HBr + S + Na 2 SO 4 .
Відповідна кислота Н 2 S 2 O 3 (тіосерна) нестійка:
Na 2 S 2 O 3 +H 2 SO 4 = Na 2 SO 4 + Н 2 S 2 O 3 .
Елементи 7-ї групи. (Галогени )
Будова електронної оболонки: … ns 2 np 5.
9 F, 17 Cl, 35 Br, 53 J, 85 At (радіоактивний). У вільному стані існують як двоатомних молекул.
Фізичні властивості
Отруйні, із різким запахом F 2 – блідо-жовтий газ, t° кип. = -188,2 ° С;
Cl 2 – зелено-жовтий газ; t° кіп. = -34,1 ° С;
Br2 – червона рідина; t° кіп. = 59,2 ° С;
J 2 – фіолетові кристали; t° кіп. = 185,5°С.
Хімічні властивості
1) Найактивніший – F 2 , у його атмосфері горять навіть скло та вода:
2F 2 + SiO 2 = SiF 4 + O 2;
2F 2 + 2H 2 O = 4HF + O 2 .
2) Вищі галогени (як сильніші окислювачі) витісняють такі з різних сполук:
F 2 + 2KCl (KBr, KJ) = 2KF + Cl 2 (Br 2, J 2).
3) При розчиненні галогенів воді та розчинах лугів йдуть реакції диспропорціонування; в залежності від температури отримують різні продукти реакції:
Cl 2 + H 2 O = HCl + HClO;
Cl 2 + 2NaOH = NaCl + NaClO;
4) Галогеноводні– усі вони безбарвні гази (HF завдяки водневим зв'язкам утворює асоціати H x F x).
По ряду: HF - HCl - HBr - HJ міцність зв'язку падає і відновлювальні властивості зростають:
MnO 2 + 4HCl = Cl 2 + MnCl 2 + 2H 2 O().
5) При розчиненні у воді одержують сильні кислоти; HJ – найсильніша (виняток становить слабка фтороводородна кислота:
H 2 F 2 H + + HF 2 -)
6) Галогенідиелементів мають різний кислотно-основний характер, який проявляється:
а) у реакціях гідролізу
AlCl 3 + H 2 O AlOHCl 2 + HCl;
PBr3+3H2O=H3PO3+3HBr.
б) у реакціях комплексоутворення
2NaF + SiF 4 ® Na 2;
по ряду лігандів F -; Cl -; Br -; J – стійкість комплексів зменшується.
7) Галогени у вищих ступенях окислення
а) оксиди: Cl2O; (ClO 2) 2; (ClO 3) 2; Cl 2 O 7;
б) кислоти: HClO; HClO 2; HClO 3; HClO 4;
по ряду кислот ® сила зростає, для кислот та їх солей з цього ж ряду окислювальні властивості зменшуються.
в) кислоти та їх солі при нагріванні розкладаються:
г) сполуки між галогенами: їх відомо дуже багато; склад відповідає положенню елементів у Періодичній системі (більше електронегативні елементи стоять наприкінці формул):
ClF, BrF, JF; ClF 3, JF 3; ClF 5, ClOF 3; BrF 7 , JO 3 F та ін;
мають кислотний характер: JF 7 + 4H 2 O = 7HF + HJO 4;
ClO 3 F + 2NaOH = NaClO 4 + NaF + H 2 O.
Питання для закріплення матеріалу:
1. Яка речовина утворюється при взаємодії миш'яку з концентрованою азотною кислотою - а) As (NО 3) 3? б) H 3 AsO 4? в) As 2 Про 3?
2. Яка речовина реагує з концентрованою кислотою з виділенням вільного хлору - а) СаС1 2? б) МпО 2? в) СrС1 3?
ЛЕКЦІЯ №16
ТЕМА: 2.1.3. «ГОЛОВНА ПІДГРУПА V ГРУПИ. З'ЄДНАННЯ АЗОТУ»
МОТИВАЦІЯ.
У повітрі міститься близько 78% азоту за обсягом.
Азот входить до складу органічних та неорганічних сполук: амінокислот, білків, нітратів та ін.
Азот є вихідною сировиною для одержання аміаку, азотної кислоти та азотних добрив.
З аміаку одержують азотну кислоту, гідроксид амонію тощо. Нашатирний спирт широко застосовується у медицині.
Азотна кислота є одним з основних реактивів, що застосовуються у фарм. аналіз. Необхідно бути обережними при роботі з кислотою. У медицині застосовується у розрахованих концентраціях для виведення бородавок.
Знання цієї теми необхідне вивчення хімічних і спеціальних дисциплін.
1.Під час лекції студенти повинні отримати уявлення про елемент V групи - азот і його сполуки: аміак, солі амонію, оксиди азоту, азотисту кислоту та її солі, про властивості азотної кислоти та її солей, техніку безпеки при роботі з азотною кислотою.
2. Забезпечити під час заняття засвоєння наступних знань: - Показники елементів V групи головної підгрупи за становищем у ПСХЭ ім. Д.І. Менделєєва;
Фізичні та хімічні властивості азоту;
Особливі властивості азотної кислоти.
ВВС: Теми: «Класи неорганічних сполук»,
«Періодичний закон та періодична система хімічних елементів ім. Д.І. Менделєєва», «Хімічний зв'язок».
«Окисно-відновні реакції»
"Теорія електролітичної дисоціації".
аналітична хімія т. «Аніони»
т. «Кач. реакції на аніони I-III гр.
т. "Метод кислотно-основного титрування".
Хот. «Аміни»
Т. «Азо - та діазосполуки
ПИТАННЯ ДЛЯ АКТУАЛІЗАЦІЇ ЗНАНЬ СТУДЕНТІВ.
1. Перелічити елементи групи V головної підгрупи.
2. Як визначити найвищу валентність цих елементів?
3. Чому найвища валентність азоту дорівнює трьом?
4. Які вищий і нижчий ступінь окислення азоту?
5. У яких сполуках атом азоту виявлятиме ступінь окислення (−3)?
6. Які оксиди здатний утворювати азот?
ВИМОГИ ДО РЕЗУЛЬТАТІВ ОСВІЙЛЕННЯ ТЕМИ:
Фармацевт повинен мати загальними компетенціями,що включають здатність (по базовій підготовці):
ОК 1. Розуміти сутність та соціальну значущість своєї майбутньої професії, виявляти до неї стійкий інтерес.
ОК 2. Організовувати власну діяльність, вибирати типові методи та способи виконання професійних завдань, оцінювати їх ефективність та якість.
ОК 3. Приймати рішення у стандартних та. нестандартних
ситуаціях та нести за них відповідальність. .
ОК 4. Здійснювати пошук та. використання інформації, необхідної для ефективного виконання професійних завдань, професійного та особистісного розвитку.
ОК 5. Використовувати інформаційно-комунікаційні технології у професійній діяльності.
ОК 6. Працювати в колективі та в команді, ефективно спілкуватися
із колегами, керівництвом, споживачами.
ОК 8. Самостійно визначати завдання професійного та
особистісного розвитку, займатися самоосвітою, усвідомлено
планувати підвищення власної кваліфікації.
Фармацевт повинен "володіти професійними
компетенціями,відповідними основним видам професійної діяльності (за базовою підготовкою):
ПК 1.6. Дотримуватись правил санітарно-гігієнічного режиму, охорони праці, техніки безпеки та протипожежної безпеки.
ПК 2.3. Володіти обов'язковими видами внутрішньоаптечного контролю
лікарських засобів.
ПК 2.4. Дотримуватись правил санітарно-гігієнічного режиму, охорони праці, техніки безпеки та протипожежної безпеки.
ПЛАН ЛЕКЦІЇ.
1. Загальна характеристика елементів V групи головної підгрупи періодичної системи Д. І. Менделєєва.
2. Біологічна роль азоту (самостійно)
3.Азот. Характеристика азоту, з його становища у періодичної системі, з погляду теорії будови атома, ступеня окислення, фізичні властивості, поширення у природі, способи отримання, хімічні властивості. Найважливіші сполуки азоту.
4.Аміак, його способи отримання, фізичні та хімічні властивості.
5.Солі амонію, способи отримання, властивості. Якісна реакція на катіон амонію.
6. Застосування в медицині та народному господарстві азоту та його сполук. (Самостійно) .
7. Оксиди азоту. Азотна кислота. нітрити.
Якісна реакція на нітрит – іон.
8. Азотна кислота, способи отримання, фізичні та хімічні властивості, техніка безпеки під час роботи. нітрати.
9. Якісні реакції на нітрат-аніони
I. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ЕЛЕМЕНТІВ V ГРУПИ ГОЛОВНОЇ ПІДГРУПИ.
З елементів V групи ПС для медицини цікавить головна п/група, яка включає азот, фосфор, миш'як, сурму і вісмут.
У зовнішньому шарі атома цих елементів є п'ять електронів, тому здатність до приєднання електронів виражена вони слабкіше, ніж у відповідних елементів VI і VII груп. З іншого боку, елементи головної підгрупи V гр. віддають електрони легше, ніж елементи VI та VII груп, тому їх кисневі сполуки стійкіші. Отже, елементи підгрупи виявляють одночасно позитивний і негативний ступінь окислення.
Вищий позитивний ступінь окиснення елементів цієї підгрупи
Внаслідок відносно меншої ЕО зв'язок даних елементів воднем менш полярна, ніж зв'язок з воднем елементів VI і VII груп. Внаслідок цього водневі сполуки аналізованих елементів не відщеплюються
у водному розчині іони водню і тому не мають кислотних властивостей
Висновки:
1.В зовнішньому шарі атома елементів V групи ПС є п'ять електронів;
2.Здатність до приєднання електронів виражена у них слабше, ніж у відповідних елементів VI та VII груп;
3. Елементи головної підгрупи V гр. віддають електрони легше, ніж елементи VI та VII груп;
4.Вищий позитивний ступінь окислення елементів цієї підгрупи
дорівнює + 5, а негативна – 3.
Підгрупу азоту становлять п'ять елементів: азот, фосфор, миш'як, сурма та вісмут. Це р-елементи V групи періодичної системи Д. І. Менделєєва.
На зовнішньому енергетичному рівні атоми цих елементів містять п'ять електронів, які мають конфігурацію ns2np3 та розподілені таким чином:

Тому найвищий ступінь окислення цих елементів +5, нижча -3, характерна і +3.
Наявність трьох неспарених електронів на зовнішньому рівні говорить про те, що в збудженому стані атоми елементів мають валентність 3. Зовнішній рівень атома азоту складається лише з двох підрівнів - 2s і 2р. У атомів інших елементів цієї підгрупи на зовнішніх енергетичних рівнях є вакантні осередки d-подуровня. Отже, один із s-електронів зовнішнього рівня може при збудженні перейти на d-підрівень того ж рівня, що призводить до утворення 5 неспарених електронів.

зовнішня електронна оболонка фосфору (незбуджений атом)

зовнішня електронна оболонка збудженого фосфорного атома.
Таким чином, фосфор, миш'як, сурма та вісмут у збудженому стані мають 5 неспарених електронів, і валентність їх у цьому стані дорівнює 5.
В атомі азоту збудити електрон подібним чином не можна через відсутність d-підрівня на другому рівні. Отже, пятивалентним азот бути не може, однак він може утворити четвертий ковалентний зв'язок по донорно-акцепторного механізму за рахунок неподіленої електронної пари 2s2. Для атома азоту можливий інший процес. При відриві одного з двох 2s-електронів азот перетворюється на однозарядний чотиривалентний іон N+.

Від азоту до вісмуту радіуси атомів збільшуються, а іонізаційні потенціали зменшуються. Відновлювальні властивості нейтральних атомів посилюються від N до Bi, а окисні слабшають (див. табл. 21).
З воднем азот, фосфор і миш'як утворюють полярні сполуки RH3, виявляючи негативний рівень окислення -3. Молекули RH3 мають пірамідальну форму. У цих сполуках зв'язки елементів з воднем міцніші, ніж у відповідних сполуках елементів підгрупи кисню і особливо підгрупи галогенів. Тому водневі сполуки елементів підгрупи азоту у водних розчинах не утворюють іонів водню.

З киснем елементи підгрупи азоту утворюють оксиди загальної формули R2O3 та R2O5. Оксидам відповідають кислоти HRO2 та HRO3 (і ортокислоти H3RO4, крім азоту). У межах підгрупи характер оксидів змінюється так: N2O3 – кислотний оксид; Р4О6 – слабокислотний оксид; As2O3 – амфотерний оксид з переважанням кислотних властивостей; Sb2O3 – амфотерний оксид з переважанням основних властивостей; Bi2O3 – основний оксид. Таким чином, кислотні властивості оксидів складу R2O3 та R2O5 зменшуються зі зростанням порядкового номера елемента.
Як очевидно з табл. 21 всередині підгрупи від азоту до вісмуту зменшуються неметалеві властивості і зростають металеві. У сурми ці властивості виражені однаково, у вісмуту переважають металеві, у азоту – неметалічні властивості. Фосфор, миш'як та сурма утворюють кілька алотропних сполук.
Азот.
Отримання
У лабораторіях його можна отримувати за реакцією розкладання нітриту амонію:
Реакція екзотермічна йде з виділенням 80 ккал (335 кДж), тому потрібно охолодження судини при її протіканні (хоча для початку реакції потрібно нагрівання нітриту амонію).
Практично цю реакцію виконують, додаючи по краплях насичений розчин нітриту натрію в нагрітий насичений розчин сульфату амонію, при цьому нітрит амонію, що утворюється в результаті обмінної реакції, миттєво розкладається.
Газ, що виділяється при цьому, забруднений аміаком, оксидом азоту (I) і киснем, від яких його очищають, послідовно пропускаючи через розчини сірчаної кислоти, сульфату заліза (II) і над розпеченою міддю. Потім азот осушують.
Ще один лабораторний спосіб отримання азоту – нагрівання суміші дихромату калію та сульфату амонію (у співвідношенні 2:1 за масою). Реакція йде за рівняннями:
Найбільш чистий азот можна отримати розкладанням азидів металів:
Так званий «повітряний», або «атмосферний» азот, тобто суміш азоту з благородними газами, одержують шляхом реакції повітря з розпеченим коксом, при цьому утворюється так званий «генераторний», або «повітряний», газ – сировина для хімічних синтезів та паливо. . За потреби з нього можна виділити азот, поглинувши монооксид вуглецю.
Молекулярний азот у промисловості отримують фракційною перегонкою рідкого повітря. Цим методом можна отримати і "атмосферний азот". Також широко застосовуються азотні установки та станції, в яких використовується метод адсорбційного та мембранного газоподілу.
Один з лабораторних способів - пропускання аміаку над оксидом міді (II) за температури ~700 °C:
Аміак беруть з насиченого розчину при нагріванні. Кількість CuO у 2 рази більша за розрахунковий. Безпосередньо перед застосуванням азот очищають від домішки кисню та аміаку пропусканням над міддю та її оксидом (II) (теж ~700 °C), потім сушать концентрованою сірчаною кислотою та сухою лугом. Процес відбувається досить повільно, але він того вартий: газ виходить дуже чистий.
Схема конспекту відкритого уроку на тему «Vгрупа головна підгрупа»
Тип уроку : урок вивчення нового матеріалу
Цілі уроку : Організація засвоєння нових знань та застосування раніше набутих навичок та умінь
Завдання:
Освітні : сприяти засвоєнню нових знань на основі наявних. Формування умінь та навичокскладати схему будови атома азоту із зазначенням числа електронів в електронних шарах; визначати характерну валентність та ступеня окислення азоту;розглядати хімічні властивості азоту у світлі окислювально- відновлювальних можливостей атома.
Розвиваючі : сприяти розвитку самостійного мислення, пам'яті, вміння порівнювати
Виховні : створити умови для формування особистісних якостей що забезпечують відповідальність та сумлінність учня, його критичність та самокритичність, активність та уважність при виконанні розумових процесів.
Методи проведення : пояснювально-ілюстративний, репродуктивний, частково-пошуковий.
Методика проведення : методика різнорівневого та диференційованого навчанняприйом знаходження аналогії.
Дидактичні матеріали :
Довідковий матеріал:
Періодична система елементів;
Таблиця електронегативності;
Матеріал до уроку
Підручник
Презентація
Роздатковий матеріал
Технічні засоби :
Мультимедіа
Етап уроку. Завдання на кожен етап уроку
Діяльність учня
I. Організаційний момент
Налаштовую на успішну роботу.
Сприяю вихованню самоконтролю
Привітання учнів та гостей уроку. Наголошую на відсутніх. Перевіряю готовність до уроку.
Привітання гостей та вчителі, підготовка до уроку
II.Актуалізація наявних знань 1. Підводжу до теми уроку.
На тлі ролика ведеться опис речовини з опорою на минулий досвід (природознавство, 8 клас), не згадуючи його назви
Дивляться, слухають. Передбачають тему уроку після закінчення ролика
2. Визначаю основні завдання уроку
Повинні навчитися давати характеристику елементамVгрупи головної підгрупи
Повинні знати основну валентність азоту
Повинні знати основні ступені окислення азоту
Повинні знати хімічні та фізичні властивості азоту
Запис теми уроку. Слухають та аналізують
3.Вибір диференційованої мети
Перша мета – жовта вимагає лише передачі тих знань, які Ви дізнаєтесь.
Друга мета вимагатиме вміння логічно мислити. Вміння пояснити факти, які дізнається на уроці.
Третя мета вимагатиме мобілізації всіх Ваших знань і не лише з хімії
Жовта мета (базовий рівень) - А
Зелена мета (просунутий рівень) - В
Червона мета (підвищений рівень) - З
Вміти давати характеристику елементів головної підгрупи, знати основну валентність та ступеня окиснення азоту. Знати фізичні та хімічні властивості азоту.
А + Вміти пояснювати зміни
властивостей елементів у головній
підгрупу. Вміти пояснювати окисно-відновні властивості азоту.
В+ Вміти припускати властивості
азоту, давати обґрунтування своїм висновкам, застосовувати знання практично.
III.Вивчення нового матеріалу
Розвиваю навички роботи з періодичною системою Д.І. Менделєєва, навички логічного мислення, вміння порівнювати.
Виховую уважність, акуратність
1.Робота з підручником та довідковим матеріалом (періодичною системою елементів). Відповідь на запитання. Питання виводяться на екран та прочитуються. Відповіді дублюються на екрані для звіряння.
Відповідають питанням і запис у зошитах: 1.Какие елементи ходять уVгрупу головну підгрупу?
2. Як змінюються властивості елементів групи відносно один одного зверху вниз?
Запис у зошитах. Відповідають на питання: 1. Яка будова зовнішньої електронної оболонки атомівVгрупу головну підгрупу? Учень відповідає біля дошки.
2. Як ще можна назвати елементиVгрупи головної підгрупи?
3. Чому збільшується заряд ядра елементів групи від азоту до вісмуту?
4. Чому збільшується радіус атомів у групі від азоту до вісмуту?
Запис у зошитах. Відповідають питанням: 1.Что об'єднує все елементи цієї групи? Учень відповідає біля дошки.
2. Чому збільшується атомна маса елементів групи від азоту до вісмуту?
3. Чому збільшуються металеві властивості елементів групи від азоту до вісмуту?
4. Чому зменшується електронегативність елементів у групі від азоту до вісмуту?
Активізація уваги, пізнавальної діяльності, цікавості. Міжпредметний зв'язок
Короткий нарис про відкриття азоту та його назву
Запис у зошитах, слухають.
Запис у зошитах, слухають. Відповідають з питання валентності та ступеня окислення азоту
Запис у зошитах, слухають. Відповідають на суперечливість назви та властивостей азоту
Активізація пізнавального інтересу.Розвиваю навички роботи з підручником,уміння самостійного отримання навчальними необхідної інформації, шляхом створення мінімальних умов розвитку індивідуальної спостережливості, сприяю розвитку
2.Визначення валентностей та ступеня окислення азоту на основі графічного запису будови зовнішньої електронної оболонки
Запис у зошитах
Робота біля дошки. Запис у зошитах
Робота із підручником. Пояснення та запис у зошитах
3. Первинне закріплення пройденого матеріалу
Які елементи входять уVА гурт?
Яка основна валентність азоту?
Які основні ступеня окиснення азоту?
Що означає записN -3 ?
Що означає записN +3 ?
Що означає записN 0 ?
Скласти сполуки, в яких азот виявлятиме ступінь окислення
Створюю умови для розвитку пам'яті, сприяю розвиткунавички логічного мислення, вміння порівнювати, вміння робити висновки та обґрунтовувати їх.
будова молекули простої речовини азот.
Дозволяється хорова відповідь
Запис у зошитах
Запис у зошитах
Запис у зошитах
Створюю умови для розвитку пам'яті, сприяю розвиткунавички логічного мислення, вміння порівнювати, вміння робити висновки та обґрунтовувати їх.
Хімічні властивості азоту
Азот окислювач.
Азот відновник
Запис у зошитах
Запис у зошитах
З якими елементами вступатиме в реакції азот як окислювач?
Запис у зошитах
Припустіть, до яких хімічних реакцій вступає азот?
Створюю умови для розвитку пам'яті (уроки природознавства, повторення матеріалу 8 класу), сприяю розвиткунавички логічного мислення, вміння порівнювати, робити висновки та обґрунтовувати їх.
Фізичні властивості азоту
Запис у зошитах. Відповідь на питання про фізичні властивості азоту на основі переглянутого досвіду та льонного досвіду
Запис у зошитах
Запис у зошитах
IV. Закріплення матеріалу
Створюю умови у розвиток пам'яті, на формування особистісних якостей які забезпечують відповідальність і сумлінність учня, його критичність і самокритичність. Сприяю розвиткунавички логічного мислення, вміння порівнювати.
Як поводиться азот у хімічних реакціях?
З чим вступає азот реакції як окислювач?
З чим вступає азот реакції як відновник?
Допомагають жовтій команді у відповідях
Яку роль відіграє азот у повітрі, якщо розглядати повітря як розчин?
V. Підбиття підсумків
Напутнє слово. Створення умов самооцінки своєї роботи на року
Хто набрав три жетони одного кольору?
Хто набрав більше трьох жетонів?
Хто має жетони іншого кольору?
На звороті своїх жетонів напишіть прізвище та здайте наприкінці уроку.
Здають жетони після дзвінка з уроку
Здають жетони після дзвінка з уроку
VI.Домашнє завдання
Створюю умови для розвитку пізнавальної діяльності учнів, пам'яті
Будівля виводиться на екран
Запис Д/З
§ 15 стор.52 №1
Письменно відповісти на два запитання:
Що я дізнався на пройденій темі?
Що я хотів би дізнатися (на яке питання не отримав відповідь на уроці)?
Запис Д/З
§ 15 стор.52 №1 скласти кросворд на тему уроку з 5 слів
Запис Д/З
§ 15№1
Скласти п'ять реакцій перетворення азоту
VII. Рефлексія
Визначення емоційного настою класу після уроку
Дерево «осінь-весна»
Оформлення дерева «осінь-весна»
Оформлення дерева «осінь-весна»